Химические свойства алюминия 9 класс
Алюминий
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.

Основное и возбужденное состояние
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.

Природные соединения
В природе алюминий встречается в виде минералов:
- Al2O3 — корунд
- 3BeO*Al2O3*6SiO2 — берилл (аквамарин — примесь Fe и изумруд — примесь Cr2O3)
- Al2O3*Cr2O3 — красный рубин
- Al2O3 с примесью Fe +2 /Fe +3 /Ti
- Al2O3*H2O — боксит

Получение
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3[AlF6]). Галлий, индий и таллий получают схожим образом — методом электролиза их оксидов и солей.
Химические свойства
- Реакции с неметаллами
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)

Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι — двойственный), вступает в реакции как с кислотами, так и с основаниями.
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде — выделяется водород)
При прокаливании комплексные соли не образуются, так вода испаряется — вместо них образуются (в рамках ЕГЭ) средние соли — алюминаты (академически — сложные окиселы):
Реакция с водой
При комнатной температуре не идет из-за образования оксидной пленки — Al2O3 — на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) — реакция идет.

Алюминотермия (лат. Aluminium + греч. therme — тепло) — способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.

Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом — на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)

Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок — гидроксид алюминия.
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание — Li3[Al(OH)6] — гексагидроксоалюминат лития)

© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
2.2.3. Характерные химические свойства алюминия.
Алюминий — амфотерный металл. Электронная конфигурация атома алюминия 1s 2 2s 2 2p 6 3s 2 3p 1 . Таким образом, на внешнем электронном слое у него находятся три валентных электрона: 2 — на 3s- и 1 — на 3p-подуровне. В связи с таким строением для него характерны реакции, в результате которых атом алюминия теряет три электрона с внешнего уровня и приобретает степень окисления +3. Алюминий является высокоактивным металлом и проявляет очень сильные восстановительные свойства.
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
с серой
При нагревании до 150-200 о С или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с азотом
При взаимодействии алюминия с азотом при температуре около 800 o C образуется нитрид алюминия:
с углеродом
При температуре около 2000 o C алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000 о С. В результате этой реакции образуется высокочистое расплавленное железо:
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
2Аl 0 + 6Н + = 2Аl 3+ + 3H2 0 ;
с кислотами-окислителями
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно параллельно протекают реакции:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
со щелочами
Алюминий реагирует как с водными растворами щелочей:
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
§ 53. Алюминий
 Что вам известно о физических свойствах алюминия и его применении?
Что вам известно о физических свойствах алюминия и его применении?
Алюминий — один из наиболее распространенных в природе элементов. На его долю приходится 8,13% массы земной коры. В основном он сосредоточен в минералах, называемых алюмосиликатами. К их числу относятся как обыкновенные глины и слюда, так и замечательные драгоценные камни, такие как гранат, берилл, топаз. Обратитесь к схеме 8, где дана характеристика алюминия.
Важнейшими минералами алюминия, имеющими промышленное значение, являются бокситы (Аl2O3 • Н2O), криолит (Na3AlF6.) и др.

 Лабораторный опыт. Изучение свойств алюминия. Рассмотрите образцы алюминиевой фольги и проволоки. Несколько раз согните и разогните проволоку. О каком свойстве алюминия позволяют судить эти действия? Поцарапайте поверхностную оксидную пленку на проволоке. Что вы наблюдаете?
Лабораторный опыт. Изучение свойств алюминия. Рассмотрите образцы алюминиевой фольги и проволоки. Несколько раз согните и разогните проволоку. О каком свойстве алюминия позволяют судить эти действия? Поцарапайте поверхностную оксидную пленку на проволоке. Что вы наблюдаете?
На поверхности алюминия тонкая и прочная, но отслаивающаяся при механическом воздействии (сгибании — разгибании) пленка. Ее толщина всего 0,00001 мм, но она надежно защищает металл от атмосферных воздействий, обеспечивая высокую коррозионную устойчивость.
Химические свойства алюминия
1. Отношение к простым веществам:
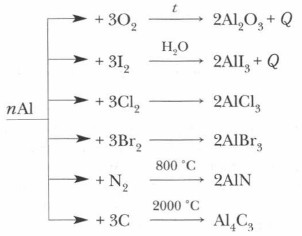
2. Взаимодействие со сложными веществами:
а) взаимодействие с водой
 Лабораторный опыт. Окисление алюминия. Полученный от лаборанта кусочек алюминиевой проволоки зачистите с целью удаления оксидной пленки и поместите в стакан с водой.
Лабораторный опыт. Окисление алюминия. Полученный от лаборанта кусочек алюминиевой проволоки зачистите с целью удаления оксидной пленки и поместите в стакан с водой.
Наблюдайте выделение водорода и образование студенистого осадка гидроксида алюминия. Когда наберется достаточно много осадка, извлеките проволоку из воды, обсушите фильтровальной бумагой и положите на подставку. Через несколько минут рассмотрите образовавшийся на поверхности алюминия оксид.
Зарисуйте алюминиевую проволоку до опыта и после него.
Сущность процессов выражается уравнениями:
 б) взаимодействие с оксидами металлов — алюмотермия (алюминотермия) Вследствие высокого сродства алюминия к кислороду этот металл способен восстанавливать многие другие металлы (вольфрам, ванадий, хром) из их соединений:
б) взаимодействие с оксидами металлов — алюмотермия (алюминотермия) Вследствие высокого сродства алюминия к кислороду этот металл способен восстанавливать многие другие металлы (вольфрам, ванадий, хром) из их соединений:
в) взаимодействие с кислотами и щелочами
Алюминий реагирует с соляной и разбавленной серной кислотами:
но не взаимодействует при нормальных условиях с очень разбавленными и концентрированными растворами азотной кислоты (пассивируется).
После удаления оксидной пленки алюминий активно взаимодействует со щелочами, образуя комплексные соединения (гексагидроксоалюминаты). Сущность процесса взаимодействия алюминия со щелочью можно выразить следующим уравнением реакции:
Алюминий, его физические и химические свойства. Химия. 9 класс. Конспект урока
Цели урока:
- продолжить формирование представлений у учащихся о переходных элементах, умения составлять уравнения химических реакций с участием простых веществ;
- Развитие умений логически рассуждать, обобщать, делать выводы, работать с дополнительной литературой;
- Формирование умений работать в группе, способствовать формированию культуры умственного труда, уверенности в своих силах, воспитание коммуникативности, ответственности .
Оборудование: Алюминий (фольга, пудра, лист, проволока), растворы HCl, H2SO4, CuSO4,пробирки, штативы, дистиллированная вода.
Тип урока: изучение нового материала.
Вид урока: урок-исследование
Ход урока
1. Организационная часть урока
2. Актуализация знаний учащихся
Проверка домашнего задания: самопроверка и самооценка.
(На доске уравнения реакций.)
Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
2. Mg → MgO → MgCl2 → Mg(OH)2 → MgO
MgO + 2HCl = MgCl2 + H2O
III. Изучение нового материала
1. Учитель: Сегодня вы проведете независимое расследование в удивительном мире металлов. Мы с вами уже познакомились с 2 семействами металлов. И поведем разговор о простом веществе – металле, рассмотрим его с точки зрения разных наук. Ведь, как известно, химия – наука, в которой переплелись и биология, и история и физика. А о каком металле пойдет речь, вы скажете сами, прослушав стих-загадку.
В тринадцатой квартире
Живу, известный в мире
Как проводник прекрасный.
Пластичен, серебрист.
Еще по части сплавов завоевал я славу
И в этом деле я специалист.
Вот мчусь я, словно ветер,
В космической ракете.
Спускаюсь в бездну моря,
Там знают все меня.
По внешности я видный,
Хоть пленкою оксидной
Покрыт, она мне – прочная броня.
Я мягкий, легкий, ковкий
Сверкаю в упаковке.
Обернуты конфеты блестящею фольгой.
Для плиток шоколада
Меня немало надо,
А раньше был я очень дорогой.
О каком металле пойдет речь?
(На доске появляется словосочетание «Крылатый металл».)
2. Для получения достоверных и разнообразных сведений об алюминии, мы разделимся на оперативные группы: историков, физиков, биологов и геологов. Каждая группа получит инструкцию по проведению расследования и необходимую литературу: учебники, рефераты учащихся, энциклопедию по неорганической химии, журнал «Химия в школе».
У каждого из вас карта независимого расследования. Ваша задача: заполнить все 4 блока по мере поступления сведений об алюминии. Итак, запишем тему урока «Алюминий, его физические и химические свойства».
Историки получают инструкцию и заполняют 1 блок «ИСТОРИЯ», физики – 2 блок «ФИЗИКА», биологи – 3 блок «БИОЛОГИЯ», геологи — 4 блок «ГЕОЛОГИЯ», а за мной остается 5 блок «Химические свойства алюминия.
Каждая группа работает по инструкции в течение 5 минут, затем – устный отчет каждой группы.
Инструкция составления исторической справки группой историков
Цель: Подготовить историческую справку об открытии алюминия.
- Прочитайте текст.
- Внесите в блок «ИСТОРИЯ» своей карты расследования сведения об открытии алюминия.
- Подготовьте устный отчет.
Инструкция проведения «следственного эксперимента» группой физиков
Цель: Выявить физические свойства алюминия.
- Покажите на таблице кристаллическую решетку алюминия.
- Прочитайте текст.
- Внесите в блок «ФИЗИКА» своей карты расследования сведения о физических свойствах алюминия и подумайте, какое физическое свойство алюминия вы могли бы продемонстрировать сами.
- Подготовьте устный отчет.
Инструкция проведения «биохимического анализа» группой биологов.
Цель: Выявить содержание алюминия в живой природе.
- Прочитайте текст.
- В блок «БИОЛОГИЯ» своей карты расследования внесите сведения о содержании алюминия в живых организмах.
- Подготовьте устный отчет.
Инструкция проведения «дактилоскопического исследования » группой геологов.
Цель: Выявить области распространения алюминия.
- Прочитайте текст.
- В блоке «ГЕОЛОГИЯ» своей карты расследования обозначьте места распространения алюминия.
- В виде, каких соединений встречается алюминий в природе? Покажите образцы.
- Подготовьте устный отчет.
3. Учитель на доске заполняет такую же карту расследования по мере выступления участников расследования. (Приложение 1.)
4. Учитель: Настало время провести химическую экспертизу предложенных материалов.
– Какова особенность строения атома алюминия?
– Как это отразится на химических свойствах?
– С какими веществами взаимодействует алюминий?
Объяснение учителя с демонстрацией опытов.
1. С неметаллами Г2; S, C
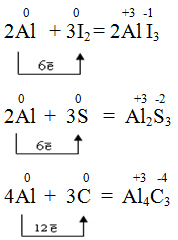
2. С кислородом O2 (демонстрация опыта)
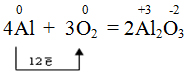
3. C водой (при обычных условиях нет)
4. С растворами кислот: HCl, H2SO4 (лабораторный опыт)
А вот концентрированные серная и азотная кислоты пассивируют алюминий, образуя на поверхности металла плотную, прочную пленку, которая препятствует дальнейшему протеканию реакции.
Где можно использовать это свойство алюминия?
5. С растворами щелочей, образуя алюминаты
Вывод: Алюминий – переходный металл.
6. С растворами солей (лабораторный опыт)
7. С оксидами металлов (алюминотермия)
5. Итак, по результатам нашего расследования составьте досье на алюминий.
Алюминий – переходный металл, открытый сравнительно недавно. В химических реакциях – восстановитель с постоянной степенью окисления +3. Взаимодействует с простыми веществами: галогенами, серой, углеродом, кислородом. Также взаимодействует со сложными веществами: с водой, растворами кислот, щелочей. На его свойствах основано широкое применение алюминия в народном хозяйстве.
6. Выводы. Обобщение материала в форме игры «Логические цепочки».
Начало фразы «Алюминий – металл…». Далее ученик повторяет его и составляет предложения, характеризующие алюминий со словами
- «потому что»
- «следовательно»
- «однако»
IV. Итог урока
V. Домашнее задание
§13. Проведите повторный физико-химический анализ – выучите материал по учебнику. Напишите «досье» на алюминий или сказку про алюминий.
Физические и химические свойства алюминия
Атомная масса – 27 а.е.м. Электронная конфигурация внешнего энергетического уровня – 3s 2 3p 1 . В своих соединениях алюминий проявляет степень окисления равную «+3».
Химические свойства алюминия
Алюминий в реакциях проявляет восстановительные свойства. Поскольку при пребывании на воздухе на его поверхности образуется оксидная пленка, устойчив к взаимодействию с другими веществами. Например, алюминий пассивируется в воде, концентрированной азотной кислоте и растворе дихромата калия. Однако, после удаления с его поверхности оксидной пленки способен взаимодействовать с простыми веществами. Большинство реакций протекает при нагревании:
2Al + 3F2 = 2AlF3 (t );
);
2Alpowder + 3Hal2 = 2AlHal3 (t  = 25
= 25 C);
C);
2Al + N2 = 2AlN (t );
);
2Al +3S = Al2S3 (t );
);
4Al + 3Cgraphite = Al4C3 (t );
);
4Al + P4 = 4AlP (t , в атмосфере Н2).
, в атмосфере Н2).
Также, алюминий после удаления с его поверхности оксидной пленки способен взаимодействовать с водой с образованием гидроксида:
Алюминий проявляет амфотерные свойства, поэтому он способен растворяться в разбавленных растворах кислот и щелочах:
Алюмиотермия – способ получения металлов из их оксидов, основанный на восстановлении этих металлов алюминием:
Физические свойства алюминия
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот. Температура плавления – 660,37 С, кипения – 2500
С, кипения – 2500 С.
С.
Получение и применение алюминия
Алюминий получают электролизом расплава оксида этого элемента:
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3[AlF6] и Al2O3. Реакция протекает при нагревании до 960 С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
Алюминий нашел широкое применение в промышленности, так, сплавы на основе алюминия – основные конструкционные материалы в самолето- и судостроении.
Примеры решения задач
| Задание | при взаимодействии алюминия с серной кислотой образовался сульфат алюминия массой 3,42 г. Определите массу и количество вещества алюминия, вступившего в реакцию. |
| Решение | Запишем уравнение реакции: |
Молярные массы алюминия и сульфата алюминия, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 27 и 342 г/моль, соответственно. Тогда, количество вещества образовавшегося сульфата алюминия будет равно:
Согласно уравнению реакции n(Al2(SO4)3): n(Al) = 1:2, следовательно n(Al) = 2×n(Al2(SO4)3 ) = 0,02 моль. Тогда, масса алюминия будет равна:
m(Al) = 0,02×27 = 0,54 г.
| Задание | Какую массу алюминия необходимо взять для получения 15,2 г хрома из оксида хрома (III) алюмотермическим способом? |
| Решение | Запишем уравнение реакции получения хрома алюмотермическим способом из его оксида: |
Молярные массы алюминия и хрома, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 27 и 52 г/моль, соответственно. Тогда, количество вещества образовавшегося хрома будет равно:
n(Cr) = 15,2 / 52 = 0,29 моль.
Согласно уравнению реакции n(Cr): n(Al) = 2:2, следовательно n(Al) = n(Cr) = 0,29 моль. Тогда, масса алюминия будет равна:
Химические свойства алюминия 9 класс
Ключевые слова конспекта: алюминий, свойства алюминия, получение и применение алюминия, алюмосиликаты, глина, оксид алюминия, боксит, дюралюмин, дюраль.
Алюминий Al – элемент № 13, 3–го периода, IIIA группы, Ar (Al) = 27. Электронная конфигурация невозбуждённого атома алюминия 1s 2 2s 2 2p 6 3s 2 3p 1 :

Алюминий является р-элементом. В своих соединениях он всегда имеет степень окисления +3. Оксид и гидроксид алюминия (Al2O3 и Al(ОН)3 соответственно) амфотерны. Существует водородное соединение алюминия – гидрид алюминия AlH3 (алан) – белый порошок.
По распространённости в земной коре алюминий занимает 4-е место (после О, Si, Н). Основная масса алюминия сосредоточена в алюмосиликатах. Продуктом разрушения алюмосиликатов является глина, она состоит из каолинита – Al2O3 • 2SiO2 • 2H2O. Обычно глина содержит примесь соединений железа, придающую ей бурый цвет. Из других минералов наибольшее распространение имеет боксит – Al2O3 • nH2O.
АЛЮМИНИЙ – ПРОСТОЕ ВЕЩЕСТВО
Алюминий – серебристо-белый металл (на воздухе покрывается плотной тонкой плёнкой оксида), плотность 2,7 г/см 3 (лёгкий металл), легкоплавкий (t°пл. = 660 °С).
На воздухе алюминий покрывается прочной тончайшей (10 –8 м) защитной плёнкой оксида, которая препятствует проникновению кислорода к металлу и практически полностью прекращает дальнейшее окисление.
Алюминиевый порошок сгорает при нагревании в кислороде:
При окислении алюминия выделяется большое количество теплоты. Нагретый порошок алюминия при попадании в атмосферу кислорода реагирует с выделением огромного количества теплоты, достигается температура до 3000–3500 °С. Тепловой эффект реакции алюминия с кислородом чрезвычайно высок, образование этого соединения энергетически очень выгодно.
При нагревании алюминий легко реагирует с серой: 
Алюминиевый порошок легко реагирует с галогенами и сгорает в атмосфере хлора. Кусочек алюминия, с которого снята оксидная плёнка, бурно реагирует с бромом. Эти реакции идут без нагревания: 
Алюминиевый порошок реагирует с кристаллическим йодом, в присутствии катализатора (или при нагревании) выделяются капельки воды.
Алюминий без оксидной плёнки реагирует с азотом при сильном нагревании (800–1200 °С), образуя нитрид алюминия: 
При сильном нагревании (1500–1700 °С) алюминий реагирует с углеродом (графитом) с образованием карбида алюминия: 
Алюминий непосредственно не реагирует с водородом. Гидрид алюминия получают косвенным путём.
Алюминий энергично взаимодействует с водой, если механическим путём или амальгамированием снять предохраняющее действие оксидной плёнки: 
Вследствие высокого теплового эффекта соединения алюминия с кислородом алюминий активно восстанавливает многие металлы из оксидов (алюмотермия): 
При этом реакция обычно сопровождается выделением большого количества тепла и повышением температуры до 1200–3000 °С. Алюмотермия применяется в производстве марганца, хрома, ванадия, вольфрама, ферросплавов.
Как метод получения металлов, алюмотермия была предложена Н. Бекетовым в 1859 г. Её используют для получения многих металлов (Мп, Cr, V, W, Sr, Ва и др.).
Алюминий реагирует с галогеноводородными кислотами, разбавленной серной и азотной кислотами с образованием солей, в которых алюминий находится в катионной форме, и выделением водорода. Например: 
Алюминий не реагирует с азотной и серной концентрированными кислотами в обычных условиях. На поверхности алюминия образуется защитная оксидная плёнка, алюминий пассивируется. Алюминий реагирует с разбавленной азотной кислотой (2–3 моль/л) с образованием нитрата алюминия, нитрата аммония и воды: 
Алюминий активно взаимодействует с растворами щелочей. Щёлочи растворяют оксидную плёнку на поверхности алюминия. Образуются соли, в которых алюминий находится в анионной форме, и выделяется водород: 
Алюминий реагирует с растворами солей, восстанавливая катионы менее активных металлов (металлов, расположенных в ряду напряжений правее алюминия): 
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЛЮМИНИЯ
Основным сырьём для производства алюминия служат бокситы, содержащие 32–60% глинозёма Al2O3. Алюминий получают электролизом расплава глинозёма Al2O3 в расплавленном криолите Na3AlF6. В электролизёре находится 6–8% глинозёма и 92– 94% криолита. Криолит в ходе электролиза не расходуется. Его получают искусственным путём – взаимодействием Al(ОН)3, HF и Na2CO3.
На катоде происходит восстановление алюминия: Al 3+ + 3е – → Al 0 ,
на аноде – окисление его оксида: 2Al2О3 – 12е – → 4Al 3+ + 3O2↑,
а затем вторичная реакция на аноде: С + O2 → СO2 или 2С + O2 → 2СО
По широте применения сплавы алюминия занимают 2–е место после чугуна и стали. Алюминий – основа лёгких сплавов (например, дюралюмина, силумина), его применяют для производства различных ёмкостей и аппаратов, фольги и проволоки, в качестве раскислителя стали и восстановителя в алюмотермии. Высокая электропроводность и коррозионная стойкость позволяют применять aлюминий для изготовления электрических проводов, кабелей, конденсаторов. Лёгкость, коррозионная стойкость алюминия и относительная нетоксичность его соединений позволяют применять aлюминий для изготовления бытовой посуды, а алюминиевую фольгу – в пищевой и фармацевтической промышленности для упаковки продуктов и препаратов.
Из сплавов алюминия наиболее распространены дюралюмин, сокращённо – дюраль. Большую твёрдость дюралю по сравнению с чистым алюминием придают добавки меди, марганца и т. д. Дюралюмин – основной конструкционный материал в самолётостроении. Сплавы алюминия широко используются в автомобилестроении, судостроении, авиационной технике.
Конспект урока по химии «Алюминий: характеристика и свойства». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии


