Каким методом в металлургии получают алюминий?
Производство алюминия
«В природе ничто не возникает мгновенно и ничто не появляется в свете в совершенно готовом виде».
Александр Герцен
русский публицист, писатель

Производство металла делится на три основных этапа: добыча бокситов – алюминийсодержащей руды, их переработка в глинозем – оксид алюминия, и, наконец, получение чистого металла с использованием процесса электролиза – распада оксида алюминия на составные части под воздействием электрического тока. Из 4-5 тонн бокситов получается 2 тонны глинозема, из которого производят 1 тонну алюминия.
В мире существуют несколько видов алюминиевых руд, но основным сырьем для производства этого металла являются именно бокситы. Это горная порода, состоящая, в основном, из оксида алюминия с примесью других минералов. Боксит считается качественным, если он содержит более 50% оксида алюминия.

Бокситы могут сильно отличаться друг от друга. По структуре они бывают твердые и плотные либо рыхлые и рассыпчатые. По цвету – как правило, кирпично-красные, рыжеватые или коричневые из-за примеси оксида железа. При небольшом содержании железа бокситы имеют белый или серый цвет. Но иногда встречаются руды желтого, темно-зеленого цвета и даже пестрые – с голубыми, красно-фиолетовыми или черными прожилками.
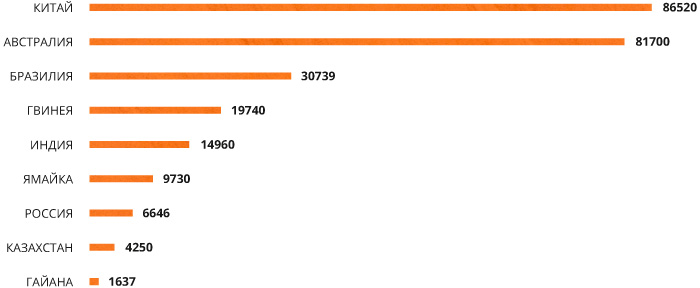
Около 90% мировых запасов бокситов сосредоточено в странах тропического и субтропического поясов – из них 73% приходится на пять стран: Гвинею, Бразилию, Ямайку, Австралию и Индию. В Гвинее бокситов больше всего – 5,3 миллиарда тонн (28,4%), при этом они высокого качества, содержат минимальное количество примесей и залегают практически на поверхности.
Следующим этапом является производственной цепочки является переработка бокситов в глинозем – это оксид алюминия Al2O3, который представляет собой белый рассыпчатый порошок. Основным способом получения глинозема в мире является метод Байера, открытый более ста лет назад, но актуальный до сих пор – около 90% глинозема в мире производятся именно так. Этот способ весьма экономичен, но использовать его можно только при переработке высококачественных бокситов со сравнительно низким содержанием примесей – в первую очередь кремнезема.
Метод Байера основан на следующем: кристаллическая гидроокись алюминия, входящая в состав боксита, хорошо растворяется при высокой температуре в растворе едкого натра (каустической щёлочи, NaOH) высокой концентрации, а при понижении температуры и концентрации раствора вновь кристаллизуется. Посторонние, входящие в состав боксита (так называемый балласт), не переходят при этом в растворимую форму или перекристаллизовываются и выпадают в осадок до того, как производится кристаллизация гидроокиси алюминия. Поэтому после растворения гидроокиси алюминия балласт легко может быть отделен – он называется красный шлам.
Это густая масса красно-бурого цвета, состоящая из соединений кремния, железа, титана и других элементов. Его складируют на тщательно изолированных территориях – шламохранилищах. Их обустраивают таким образом, чтобы содержащиеся в отходах щёлочи не проникали в грунтовые воды. Как только хранилище отрабатывает свой потенциал, территорию можно вернуть в первоначальный вид, покрыв её песком, золой или дёрном и посадив определённые виды деревьев и трав. На полное восстановление могут уйти годы, но в итоге местность возвращается в изначальное состояние.
Многие специалисты не считают красный шлам отходом, так как он может служить сырьем для переработки. Например, из него извлекают скандий для дальнейшего производства алюминиево-скандиевых сплавов. Скандий придает таким сплавом особую прочность, сферы использования – автомобиле- и ракетостроение, спортивная экипировка, производство электропроводов.
Также красный шлам может использоваться для производства чугуна, бетона, получения редкоземельных металлов.

У глинозема нет срока годности, но хранить его непросто, так как при малейшей он возможности активно впитывает влагу – поэтому производители предпочитают как можно быстрее отправлять его на алюминиевое производство. Сначала глинозем складывают в штабели весом до 30 тысяч тонн – получается своеобразный слоеный пирог высотой до 10-12 метров. Потом пирог «нарезают» и грузят для отправки в железнодорожные вагоны – в среднем, в один вагон от 60 до 75 тонн (зависит от вида самого вагона).
Существует еще один, гораздо менее распространенный способ получения глинозема – метод спекания. Его суть заключается в получения твердых материалов из порошкообразных при повышенной температуре. Бокситы спекают с содой и известняком – они связывают кремнезем в нерастворимые в воде силикаты, которые легко отделить от глинозема. Этот способ требует больших затрат, чем способ Байера, но в то же время дает возможность перерабатывать бокситы с высоким содержанием вредных примесей кремнезема.

Глинозем выступает непосредственным источником металла в процессе производства алюминия. Но для создания среды, в которой этот процесс будет происходить, необходим еще один компонент – криолит.
Это редкий минерал из группы природных фторидов состава Na3AlF6. Обычно он образует бесцветные, белые или дымчато-серые кристаллические скопления со стеклянным блеском, иногда – почти черные или красновато-коричневые. Криолит хрупкий и легко плавится.
Природных месторождений этого минерала крайне мало, поэтому в промышленности используется искусственный криолит. В современной металлургии его получают взаимодействием плавиковой кислоты с гидроксидом алюминия и содой.

Ток для производства алюминия
Для запуска двигателя автомобильный аккумулятор должен обеспечить электрический ток в 300-350 А в течение 30 секунд. То есть в 1000 раз меньше, чем нужно одному электролизеру для постоянной работы.
В каждой ванне происходит процесс электролиза алюминия. Емкость ванны заполняется расплавленным криолитом, который создает электролитическую (токопроводящую) среду при температуре 950°С. Роль катода выполняет дно ванны, а анода – погружаемые в криолит угольные блоки длиной около 1,5 метров и шириной 0,5 метра, со стороны они выглядят как впечатляющих размеров молот.
Каждые полчаса при помощи автоматической системы подачи глинозема в ванну загружается новая порция сырья. Под воздействием электрического тока связь между алюминием и кислородом разрывается – алюминий осаждается на дне ванны, образуя слой в 10-15 см, а кислород соединяется с углеродом, входящим в состав анодных блоков, и образует углекислый газ.
Примерно раз в 2-4 суток алюминий извлекают из ванны при помощи вакуумных ковшей. В застывшей на поверхности ванны корке электролита пробивают отверстие, в которое опускают трубу. Жидкий алюминий по ней засасывается в ковш, из которого предварительно откачан воздух. В среднем, из одной ванны откачивается около 1 тонны металла, а в один ковш вмещается около 4 тонн расплавленного алюминия. Далее этот ковш отправляется в литейное производство.
При производстве каждой тонны алюминия выделяется 280 000 м 3 газов. Поэтому каждый электролизер независимо от его конструкции оснащен системой газосбора, которая улавливает выделяющиеся при электролизе газы и направляет их в систему газоочистки. Современные «сухие» системы газоочистки для улавливания вредных фтористых соединений используют ни что иное, а глинозем. Поэтому перед тем как использоваться для производства алюминия, глинозем на самом деле сначала участвует в очистке газов, которые образовались в процессе производства металла ранее. Вот такой замкнутый цикл.
Для процесса электролиза алюминия требуется огромное количество электроэнергии, поэтому важно использовать возобновляемые и не загрязняющие окружающую среду источники этой энергии. Чаще всего для этого используются гидроэлектростанции – они обладают достаточной мощностью и не имеют выбросов в атмосферу. Например, в России 95% алюминиевого мощностей обеспечены гидрогенерацией. Однако есть в места в мире, где угольная генерация пока доминирует – в частности, в Китае на нее приходится 93% производства алюминия. В результате для производства 1 тонны алюминия с использованием гидрогенерации в атмосферу выделяется чуть более 4 тонн углекислого газа, а при использовании угольной генерации – в пять раз больше – 21,6 тонны.
Производство алюминия от сырья до технологии
Алюминий является одним из самых распространенных химических элементов на Земле, используется в машиностроении, энергетике и строительстве. Ежегодно добыча и потребление этого металла увеличивается на 7%. Производство алюминия является сложным техническим процессом и требует большого количества энергетических, транспортных, трудовых и сырьевых ресурсов.

Производство алюминия в России и мире
Объем производства алюминия в 2019 году составляет 72 млн тонн. Международный алюминиевый рынок находится в дефиците, составляющем 277 тыс. тонн.Крупнейшими странами-изготовителями данного металла являются Китай, Россия, США, Австралия, Бразилия и Индия. Страны Северной и Южной Америки активно сокращают добычу бокситов. Рост производства чистого алюминия обеспечивается государствами Ближнего Востока и Азии. В этих регионах содержится свыше 73% мировых запасов алюминиевых руд, залегающих на земной поверхности. В них отсутствует большое число металлических и газообразных веществ. Крупнейшими производителями алюминия в мире являются следующие транснациональные компании:
- UCRUSAL: российский концерн, производящий 13% всех алюминиевых сплавов в мире. Объем производства компании составляет 3,75 млн тонн в год. РУСАЛ обладает собственной инженерно-технической базой и экспортирует свою продукцию в страны Европы, Северной Америки и Юго-Восточной Азии.
- Chalco: китайская государственная корпорация, являющаяся вторым крупнейшим производителем алюминиевых материалов в мире. Объем производства составляет 3,4 млн тонн в год.
- RioTinto: австралийско-британская горно-металлургическая компания, производящая глинозем. Объем производства концерна составляет 3,1 млн тонн в год. RioTinto образует с канадской организацией Alcan совместное предприятие по добыче бокситов.
На рынке стран-лидеров по производству чистого алюминия наблюдается переизбыток мощностей. Это обусловлено циклическим характером спроса и большим количеством конкурентоспособных предприятий. Для снижения переизбытка мощностей многие предприятия стали экспортировать алюминиевые полуфабрикаты. С 2015 г. продажи этой продукции ежегодно растут на 20%.
В Российской Федерации присутствует 17 заводов по изготовлению глинозема и алюминиевых листов. Большая часть предприятий располагается на Урале в и в Сибири. Высокая эффективность российских алюминиевых заводов обуславливается следующими факторами размещения производства:
- Сырьевой: предприятия расположены рядом с основными месторождениями алюминия. Это позволяет снизить затраты на транспортировку сырья и снизить стоимость готовой продукции
- Энергетический: чистый алюминий изготавливается посредством электролиза, поэтому заводы расположены рядом с крупными гидроэлектростанциями, вырабатывающими большое количество электрической энергии.
- Потребительский фактор: продукция российский компаний, производящих алюминий, покупается странами Южной и Северной Америки, Азии, Ближнего Востока, Европы и Африки.
- Транспортный: заводы располагаются рядом с крупными транспортными узлами, позволяющими эффективно перевозить сырье и готовую продукцию на большие расстояния. Для транспортировки металла чаще всего используются железнодорожные поезда.
В настоящее время производство алюминия в России снижается и составляет 7,3 млн тонн в год. Это связано с разрушением межотраслевых и хозяйственных связей со странами бывшего СССР.
Технология производства
Технология производства алюминия включает в себя 3 основных этапа:
- Добыча боксита.
- Переработка алюминийсодержащих руд в глинозем.
- Выделение чистого металла из глинозема посредством электролиза и его очистка от лишних примесей.
Производство данного химического элемента осуществляется в электролизном цехе. Он состоит из нескольких корпусов протяженностью 1000 м. В нем располагаются электролизные ванны с большими проводами, подключенными к источнику питания. Ванны оборудованы электродами, находящимися под напряжением 6 В.

Большая часть процессов в электролизном цехе автоматизированы. Перед началом электролиза емкость ванн наполняется расплавленным криолитом. Это вещество предназначено для создания токопроводящей среды при высоких температурах. Дно ванны выступает в качестве катода. Анодом являются угольные блоки, погруженные в криолит.
В промышленности алюминий получают методом пирометаллургии, разработанного немецким химиком Карлом Иосифом Байером. Этот способ представляется собой восстановление металла с помощью углекислого газа или оксида углерода. Все работы на предприятии выполняются в соответствии со схемами производства алюминия, где подробно расписан процесс электролиза глинозема. Изначально в ванну загружается порция глинозема. Под воздействием электричества вещество разлагается. В результате связь между частицами алюминия и кислорода разрывается.
После электролиза на дне электролитических ванне остается чистый алюминий, находящийся в расплавленном состоянии. Кислород, вступая в реакцию углеродом, образуется углекислый газ. Полученный материал разливают по вакуумным ковшам и доставляют в литейный цех. Здесь металл подвергается термической обработке. С помощью переплавки из сплава удаляются лишние примеси. В результате вещество приобретает твердую форму и сортируется по блокам весом до 22 кг.

Алюминий сохраняет свои свойства при длительной эксплуатации. Поэтому часть алюминиевой продукции перерабатывается и повторно используется для создания чистых металлов, что оказывает положительное влияние на экологию. Объем затрат на охрану окружающей среды в этой сфере промышленности составляет 4%. Власти используют множество экономических мер в области ООС, предоставляя льготы предпринимателям, соблюдающим экологические нормы и государственные стандарты в процессе хозяйственной деятельности.
Производство глинозема
Глинозем представляет собой порошок белого цвета, образованный в результате взаимодействия алюминия с кислородом. Технологический процесс производства этого вещества был разработан Байером в конце XIXстолетия. С помощью этой технологии изготавливается 90% глинозема в мире.
При получении порошкообразного оксида алюминия методом Байера можно использовать высококачественные бокситы с низким содержанием примесей. В процессе изготовления глинозема кристаллическая гидроокись алюминия растворяется в каустической щелочи высокой концентрации. Химическая реакция осуществляется при высоких температурах. Посторонние вещества, входящие в состав боксита, при взаимодействии с раствором едкого натра выпадают в осадок. Примеси, отделенные от гидроокиси алюминия, называются красным шламом. В процессе переработки из них можно извлечь соединения кремния, железа, титана и иных химических элементов.

Крупные алюминиевые частицы с помощью фильтрации отделяются от гидроокиси алюминия. Полученное вещество промывают, высушивают и нагревают до температуры кипения воды. В результате образуется глинозем. У него отсутствует срок годности. Хранить глинозем необходимо в сухих местах. Транспортировка вещества осуществляется в железнодорожных вагонах.
Получение алюминия из глинозема
Производители активно совершенствуют технологию производства алюминия из глинозема, стараясь изготавливать металл с минимальными затратами электроэнергии и наименьшим воздействием на окружающую среду. В современных электролитических цехах используются инертные аноды, что позволяет отказаться от использования угля. Их можно использовать в течение нескольких десятилетий.

В результате использования инновационных технологий при электролизе глинозема в атмосферу не выделяется углекислый газ. В электролизных ваннах вырабатывается чистый кислород. Это позволяет снизить траты на вентиляционные механизмы, предназначенные для своевременного удаления углекислого газа из помещения. При электролизе используется не менее 2 Т глинозема, 0,1 Т криолита и небольшое количество фторидов.
Рафинирование алюминия
Образованный в результате электролиза металл содержит небольшое количество металлических и газообразных веществ:
- кремний;
- железо;
- цинк;
- углерод;
- водород;
- азот;
- озон;
- углекислый газ.
Примеси ухудшают свойства металла. Поэтому во время производства их удаляют при помощи рафинирования. Эта процедура осуществляется 2 методами:
- Хлорирование: осуществляется при температуре 750°С. Алюминий подвергается продувке хлористым раствором. Хлорирование производится в специальных ковшах в течение 12 мин.
- Электролитический способ: осуществляется с применением фтористых и хлористых солей. Металл подвергается термической обработке и анодному растворению. В результате из расплавленного вещества удаляются лишние примеси.

После процедуры рафинирования чистота металла составляет 99,5 – 99,9%. При этой процедуры также из рафинируемого вещества также удаляется 1% алюминия.
Сырье
В естественной среде алюминий встречается только в виде руд – бокситов. Эти вещества представлены виде гидроксидов, корунда и каолинита. В них содержится свыше 40 химических элементов. Содержание глинозема в бокситах составляет 45%. Одним из важнейших параметров алюминиевых руд является кремниевый модуль, характеризующий отношение содержаний оксидов алюминия и кремния. Он должен составляет не менее 2,6. В недрах Земли находится свыше 18 млрд тонн бокситов. При нынешних темпах производства из этого сырья можно производить алюминий до 2122 г.

Необходимое оборудование
Для добычи бокситов, преобразования руд в глинозем и извлечения чистого металла требуется следующее оборудование:
- Механизмы раздачи глинозема: предназначены для транспортировки порошкообразного оксида алюминия внутри цеха и дозированной подачи глинозема к электролизным машинам.
- Катодная ошиновка: представляет собой гибкие ленты катодных спусков, прикрепленных к стержням катодных шин, выполненных из стальных материалов.
- Газоочистительные установки: используются для очистки помещения от газов, образующихся во время производства фторида алюминия сухим способом.
- Монтажное оборудование: краны линейного и технического предназначения.
- Электролизер: прибор для разделения основных компонентов глинозема при помощи электрического тока во время электролиза.

В зависимости от технологических особенностей производства требуется большое количество барабанных вращающихся печей. Они используются при сухих методах производства. При организации предприятия важно обеспечить оборудование для электролиза глинозема электроэнергией.
Алюминий, его свойства, способы получения и рафинирование
Алюминий впервые выделен в свободном виде в 1825 г. датским физиком Эрстедом. В настоящее время в промышленных масштабах алюминий получают электролитическим путем. Способ получения металлического алюминия электролизом глинозема, растворенного в криолите, запатентовали в 1886 г. независимо друг от друга Поль Эру во Франции и Чарльз Хол в США.
Производство алюминия развивалось с тех пор чрезвычайно быстрыми темпами, благодаря тому значению, которое приобрел алюминий в промышленности. До 1917 г. наша страна не имела собственного алюминиевого завода, хотя русские ученые внесли большой вклад в металлургию алюминия. В 1929 г. на ленинградском заводе «Красный выборжец» был получен алюминий на Волховской энергии и на отечественном сырье. В 1932 г. пущен в строй Волховский алюминиевый завод, а в 1933 г. — Днепровский алюминиевый завод. В дальнейшем были построены алюминиевые заводы в различных районах нашей страны.
Создание мощной энергетической базы позволило нашей стране быстро выйти на одно из первых мест по производству алюминия.
Свойства алюминия
В чистом виде алюминий — металл серебристого белого цвета. Одно из важных свойств алюминия — его малая плотность: в твердом состоянии (при 20° С) она равна 2,7 г/см 3 , а в жидком виде (при 900° С) — 2,32 г/см 3 . Температура плавления высокочистого алюминия (99,996%) равна 660,24° С, температура кипения — 2500° С. Важными свойствами алюминия, определяющими его применение во многих областях промышленности, являются его хорошая электропроводность и теплопроводность.
Алюминий хорошо обрабатывается механически, обладает хорошей ковкостью, легко прокатывается в тончайший лист и проволоку. В химических реакциях алюминий амфотерен. Он растворяется в щелочах, соляной и серной кислотах, но стоек по отношению к концентрированной азотной и органическим кислотам. На внешней М-оболочке алюминия три валентных электрона, причем два — на 3s- орбите и один на 3p-орбите. Поэтому обычно в химических соединениях алюминий трехвалентен. Однако в ряде случаев алюминий может терять один p-электрон и проявлять себя одновалентным, образуя соединения низшей валентности.
Производство алюминия в настоящее время включает в себя две основные операции:
- получение безводной, свободной от сопутствующих алюминию примесей, окиси алюминия путем сложной химической переработки природных соединений (бокситов, глины, каолина);
- получение металлического алюминия методом электролиза глинозема, растворенного в криолите.
Алюминий обладает многими ценными свойствами: небольшой плотностью— около 2,7 г/см 3 , высокой теплопроводностью — около 300 Вт/(м • К) и высокой электропроводностью 13,8 • 10 7 Ом/м, хорошей пластичностью и достаточной механической прочностью.
Алюминий образует сплавы со многими элементами. В сплавах алюминий сохраняет свои свойства. В расплавленном состоянии алюминий жидкотекуч и хорошо заполняет формы, в твердом виде он хорошо деформируется и легко поддается резанию, пайке и сварке.
Сродство алюминия к кислороду очень большое. При его окислении выделяется большое количество тепла (
1670000 Дж/моль). Тонкоизмельченный алюминий при нагревании воспламеняется и сгорает на воздухе. Алюминий соединяется с кислородом воздуха и в атмосферных условиях. При этом алюминий покрывается тонкой (толщиной
0,0002 мм) плотной пленкой окиси алюминия, защищающей его от дальнейшего окисления; поэтому алюминий стоек против коррозии. Поверхность алюминия хорошо защищается от окисления этой пленкой и в расплавленном состоянии.
Сплавы алюминия
Из сплавов алюминия наибольшее значение имеют дюралюминий и силумины.
В состав дюралюминия, кроме алюминия, входят 3,4—4 % Cu, 0,5 % Mn и 0,5 % Mg, допускается не более 0,8 % Fe и 0,8 % Si. Дюралюминий хорошо деформируется и по своим механическим свойствам близок к некоторым сортам стали, хотя он в 2,7 раза легче стали (плотность дюралюминия 2,85 г/см 3 ).
Механические свойства этого сплава повышаются после термической обработки и деформации в холодном состоянии. Сопротивление на разрыв повышается со 147—216 МПа до 353— 412 МПа, а твердость по Бринелю с 490—588 до 880—980 МПа. При этом относительное удлинение сплава почти не изменяется и остается достаточно высоким (18—24 %).
Силумины — литейные сплавы алюминия с кремнием. Они обладают хорошими литейными качествами и механическими свойствами.
Алюминий и сплавы широко применяют во многих отраслях промышленности, в том числе в авиации, транспорте, металлургии, пищевой промышленности и др. Из алюминия и его сплавов изготовляют корпуса самолетов, моторы, блоки цилиндров, коробки передач, насосы и другие детали в авиационной, автомобильной и тракторной промышленности, сосуды для хранения химических продуктов. Алюминий широко применяют в быту, пищевой промышленности, в ядерной энергетике и электронике. Многие части искусственных спутников нашей планеты и космических кораблей изготовлены из алюминия и его сплавов.
Вследствие большого химического сродства алюминия к кислороду его применяют в металлургии как раскислитель, а также для получения при использовании так называемого алюминотермического процесса трудно восстанавливаемых металлов (кальция, лития и др.). По общему производству металла в мире алюминий занимает второе место после железа.
Сырые материалы для производства алюминия
Основным современным способом производства алюминия является электролитический способ, состоящий из двух стадий. Первая — это получение глинозема (Al2O3) из рудного сырья и вторая — получение жидкого алюминия из глинозема путем электролиза.
Руды алюминия
Вследствие высокой химической активности алюминий встречается в природе только в связанном виде: корунд Al2O3, гиббсит Al2O3 • ЗН2O, бемит Al2O3 • Н2O, кианит 3Al2O3 • 2SiO2, нефелин (Na, К)2O • Al2O3 • 2SiO2, каолинит Al2O3 • 2SiO2 • 2Н2О и другие. Основными используемыми в настоящее время алюминиевыми рудами являются бокситы, а также нефелины и алуниты.
Бокситы
Алюминий в бокситах находится главным образом в виде гидроксидов алюминия (гиббсита, бемита и др.), корунда и каолинита. Химический состав бокситов довольно сложен. Они часто содержат более 40 химических элементов. Содержание глинозема в них составляет 35—60 %, кремнезема 2—20 %, оксида Fe2O3 2—40 %, окиси титана 0,01—10 %. Важной характеристикой бокситов является отношение содержаний в них Al2O3 к SiO2 по массе — так называемый кремневый модуль.
Кремневый модуль бокситов, поступающих для получения глинозема, должен быть не ниже 2,6. Для бокситов среднего качества этот модуль составляет 5—7 при 46—48 %-ном содержании Al2O3, а модуль высококачественных — около 10 при 50 %-ном содержании Al2O3. Бокситы с более высоким содержанием Al2O3 (52 %) и модулем (10—12) идут для производства электрокорунда.
К числу крупных месторождений бокситов в нашей стране относится Тихвинское (Ленинградская область), Североуральское (Свердловская область), Южноуральское (Челябинская область), Тургайское и Краснооктябрьское (Кустанайская область).
Нефелины
Нефелины входят в состав нефелиновых сиенитов и уртитов. Большое месторождение уртитов находится на Кольском полуострове. Основные компоненты уртита — нефелин и апатит ЗСа3(РO4)2 • СаF2. Их подвергают флотационному обогащению с выделением нефелинового и апатитового концентратов. Апатитовый концентрат идет для приготовления фосфорных удобрений, а нефелиновый — для получения глинозема. Нефелиновый концентрат содержит, %: 20—30 Al2O3, 42—44 SiO2, 13-14 Na2O, 6-7 К2O, 3-4 Fe2O3 и 2-3 СаО.
Алуниты
Алуниты представляют собой основной сульфат алюминия и калия (или натрия) К2SO4 • Al2(SO4)3 • 4Al(ОН)3. Содержание Al2O3 в них невысокое (20—22 %), но в них находятся другие ценные составляющие: серный ангидрид SO3 (
20 %) и щелочь Na2O • К2O (4—5 %). Таким образом, они, так же как и нефелины, представляют собой комплексное сырье.
Другие сырые материалы
При производстве глинозема применяют щелочь NaОН, иногда известняк СаСО3, при электролизе глинозема криолит Na3AlF6 (3NaF•AlF3) и немного фтористого алюминия AlF3, а также СаF2 и MgF2.
Производство криолита
Криолит в естественном виде в природе встречается очень редко и его производят искусственно из концентрата плавикового шпата (СаF2). Процесс осуществляют в две стадии, первая — это получение плавиковой кислоты HF. Тонкоизмельченный СаF2 смешивают с серной кислотой в трубчатых вращающихся печах при 200 °С. В печи протекает реакция: СаF2+Н2SO4=2НF+СаSO4. Поскольку в плавиковом шпате содержится в качестве примеси SiO2, образуется также немного летучей кремнефтористой кислоты Н2SiF6. Газообразные НF и Н2SiF6 после их очистки от примесей поглощаются в вертикальных башнях водой, в результате получают раствор плавиковой кислоты с кремнефтористой. Его очищают от Н2SiF6, добавляя немного соды: Н2SiF6+Na2CO3=Na2SiF+Н2O+СO2. Кремнефтористый натрий выпадает в осадок и получается очищенная плавиковая кислота. Вторая стадия — получение криолита. В раствор плавиковой кислоты добавляют Аl(ОН)3 и соду и проводят так называемый процесс варки криолита, в течение которого протекают следующие реакции:
Криолит выпадает в осадок, его отфильтровывают и просушивают при температуре 130—150 °С.
Фтористый алюминий получают схожим способом, добавляя к плавиковой кислоте до полной ее нейтрализации гидроксид алюминия: 3HF + Al(OH)3 = AlF3 + 3H2O.
Рафинирование алюминия
Алюминий, извлекаемый из электролизных ванн, называют алюминием-сырцом. Он содержит металлические (Fe, Si, Cu, Zn и др.) и неметаллические примеси, а также газы (водород, кислород, азот, оксиды углерода, сернистый газ). Неметаллические примеси — это механически увлеченные частицы глинозема, электролит, частицы футеровки и др.
Для очистки от механически захваченных примесей, растворенных газов, а также от Na, Са и Мg алюминий подвергают хлорированию. Для этого в вакуум-ковш вводят трубку, через которую в течение 10—15 мин подают газообразный хлор, причем для увеличения поверхности соприкосновения газа с металлом на конце трубки крепят пористые керамические пробки, обеспечивающие дробление струи газа на мелкие пузырьки. Хлор энергично реагирует с алюминием, образуя хлористый алюминий AlCl3. Пары хлористого алюминия поднимаются через слой металла и вместе с ними всплывают взвешенные неметаллические примеси, часть газов и образующиеся хлориды Na, Са, Мg и Н2.
Далее алюминий заливают в электрические печи-миксеры или в отражательные печи, где в течение 30—45 мин происходит его остаивание. Цель этой операции — дополнительное очищение от неметаллических и газовых включений и усреднение состава путем смешения алюминия из разных ванн. Затем алюминий разливают либо в чушки на конвейерных разливочных машинах, либо на установках непрерывного литья в слитки для прокатки или волочения. Таким образом получают алюминий чистотой не менее 99,8 % Аl.
Алюминий более высокой степени чистоты в промышленном масштабе получают путем последующего электролитического рафинирования жидкого алюминия по так называемому трехслойному методу. Электролизная ванна имеет стенки из магнезита, угольную подину (анод) и подвешенные сверху графитированные катоды. На подину через боковое отверстие порциями заливают исходный алюминий, поддерживая здесь анодный слой определенной толщины; выше него располагается слой электролита из фтористых и хлористых солей, а над электролитом — слой очищенного алюминия, который легче электролита; в этот слой погружены концы катодов.
Для того, чтобы рафинируемый алюминий находился внизу, его утяжеляют, формируя в анодном слое сплав алюминия с медью (в слое растворяют 30—40 % Сu). В процессе электролиза ионы Al 3+ перемещаются из анодного слоя через слой электролита в катодный слой и здесь разряжаются. Накапливающийся на поверхности ванны чистый катодный металл вычерпывают и разливают в слитки. Этим способом получают алюминий чистотой 99,95—99,99%. Расход электроэнергии равен
18000 кВт • ч на 1 т алюминия. Более чистый алюминий получают методом зонной плавки или дистилляцией через субгалогениды.
Алюминий: свойства, применение, виды, способы получения

Алюминий – металлический элемент серебристо-белого цвета, его механические характеристики и технологические свойства обеспечивают широкое применение в различных отраслях промышленности, строительстве и быту.
Алюминий сочетает малую плотность и прочность, устойчивость к коррозии и резким температурным перепадам. В периодической таблице Менделеева обозначается как Al, атомный номер – 13. Этот элемент распространен в земной коре, по содержанию в ней занимает третье место после кислорода и кремния. В недрах его содержится примерно 8%. Для сравнения – золото в земной коре присутствует в количестве, равном всего миллионным долям процента.
Технологии промышленного получения алюминия
Впервые о существовании этого металла в 16 веке догадался Парацельс, выделивший из квасцов «квасцовую землю». В нейон выявил оксид неизвестного на тот момент металла, очень заинтересовавший ученого. В 18 веке его опыты повторил немецкий химик Маргграф, который и дал имя новому элементу. В переводе с латыни переводится как «вяжущий». Только в конце позапрошлого века был найден экономически выгодный способ промышленного получения алюминия.
Чаще всего этот металл получают из бокситов –вторичных пород. Они образовались при распаде алюмосиликатов первичного происхождения, которые, в свою очередь, сформировались в высокотемпературных условиях вулканических извержений. В России алюминий выделяют из нефелиновых руд, добываемых на Кольском полуострове и в Кемеровской области. Вторичные продукты добычи Al из нефелиновых руд: портландцемент, сода, удобрения.
Популярная технология получения глинозема (оксида алюминия) из бокситов – щелочной метод Байера, разработанный российскими учеными в конце 19 века. Полученный в результате этого процесса оксид Al2O3 – прочное химическое соединение, плавящееся при +2050°C. Металл в чистом виде получают электролизным восстановлением оксида. ОсобочистыйAlполучают трехслойным электролизом. Дополнительную очистку, если такая требуется, проводят рафинирующим электролизом с электролитом из алюмоорганических соединений, а также с помощью зонного плавления или дистилляции через субфторид.
Основные свойства алюминия
Этот элемент химически активен, но образующаяся на его поверхности плотная оксидная пленка защищает полуфабрикаты и готовые изделия от коррозионного разрушения.
Для алюминия характерны следующие физические свойства:
- плотность – 2,7 г/см 3 (для сравнения – плотность железа составляет 7,85 г/см 3 );
- температура плавления +600°C (железа+1535°C);
- высокие электро- и теплопроводность;
- парамагнетизм – металл притягивается магнитом исключительно при наличии магнитного поля;
- объемная гранецентрированная металлическая кристаллическая решетка.
Основные естественные примеси, присутствующие в Al после восстановления из оксида (кремний, цинк, титан, железо, медь), влияют на физические и технологические параметры металла. Чем он чище, тем выше его электропроводность, теплопроводность, коррозионная стойкость и, конечно, цена. Основные механические параметры: предел прочности после холодного пластического деформирования– 150 МПа, относительное удлинение – 50%.
Alлегко формуется, поддается механической обработке, сваривается различными видами сварки. Для повышения коррозионной стойкости поверхность деталей и конструкций анодируют. Анодирование – электрохимический процесс создания толстой оксидной пленки.
Химические характеристики металла алюминия:
- Химическая активность. В мелкофракционном состоянии при высоких температурах Al активно соединяется с кислородом, фосфором, серой, азотом, йодом, углеродом. При комнатных температурах реагирует с бромом, хлором, щелочами.
- Взаимодействие с другими металлами с образованием сплавов, содержащих алюминиды, – интерметаллические соединения.
- При наличии на поверхности плотной оксидной пленки –стойкость к атмосферной коррозии, пресной и соленой воде, инертность к органическим кислотам, разбавленной и концентрированнойHNO3. При очищенной оксидной пленке этот металл активно вступает в реакцию с водой.
Виды алюминия по степени очистки
В зависимости от процентного содержания основного элемента принята следующая классификация степеней чистоты:
- 99,5-99,79% – промышленная чистота (техническая);
- 99,8-99,949% – высокочистая;
- 99,95-99,9959% – сверхчистая;
- 99, 9960-99,9990 % – особо чистая;
- свыше 99,999% – ультрачистая.
Алюминий технической чистоты имеет широкое применение в промышленности, где важны его главные физические свойства – небольшая плотность, электро- и теплопроводимость. Он выпускается в виде алюминиевых листов, труб, плит, прутков, профильного проката. Их применяют для изготовления деталей и элементов конструкций, не запланированных для значительных нагрузок. Из высокоочищенных материалов выпускают фольгу и токопроводящие элементы.
Виды алюминиевых сплавов
Основная область применения алюминия– производство сплавов, которые разделяют на деформируемые и литейные.
Деформируемые
Такие марки хорошо обрабатываются на всех стадиях обработки, сочетают прочность и пластичность. Используется при производстве листов, прутков, труб, поковок, штамповок. Применяемые способы деформирования: прокатка, волочение, прессование, ковка. По способности повышать прочностные характеристики деформируемые материалы на базе алюминия подразделяют на термически неупрочняемые и термически упрочняемые.
Популярный сплав, относящийся к этой группе, – дюралюминAl-Cu-Mg, в который дополнительно вводится марганец, повышающий устойчивость к коррозии. Если ранее наиболее распространенным был материал Д1, то постепенно его заменила более технологичная марка Д16. В Евросоюзе и США используются марки 2017, 2024, 2117.Дюралюмин, выпускаемый в листах, для дополнительного улучшения коррозионной стойкости плакируют – покрывают поверхность слоем чистого Al.
Еще один представитель этой группы – авиаль (АВ), материал, используемый в авиастроении. Он немного уступает по прочности дюралюминам, но превышает их по пластичности в нормальном и нагретом состояниях. Удовлетворительно обрабатывается режущими инструментами, сваривается аргонодуговой и контактной сваркой.
Высокопрочные сплавы на основе алюминия обладают повышенными прочностными свойствами, но меньшей пластичностью по сравнению с дюралюминами. Марка В95широко применяется в самолетостроении для конструкций, эксплуатируемых при температурах выше +100°C. Хорошо сваривается точечной сваркой и обрабатывается режущими инструментами.
Литейные
Алюминиевые сплавы для фасонного литья отличаются жидкотекучестью, небольшой усадкой, стойкостью к образованию горячих трещин, коррозии. Количество легирующих элементов в таких материалах выше, чем в деформируемых. Наиболее распространены композиции Al-Si, Al-Cu, Al-Mg, дополнительно легированные небольшими количествами марганца, хрома, никеля.
Примеры использования алюминия и его сплавов при производстве различных видов транспорта
Современные отрасли транспортостроения невозможно представить без материалов, созданных на основе Al, которые сочетают достаточно высокую прочность, пластичность, малую плотность и хорошую устойчивость ко многим видам коррозии.
Самолетостроение
В РФ при создании авиационной техники широко используют тремоупрочняемые высокопрочные марки, содержащие, помимо AL, цинк, магний, медь. Марки повышенной прочности и среднепрочные, не имеющие в своем составе цинка, используются для изготовления киля, крыла, фюзеляжа. Для гидросамолетов востребованы магнийсодержащие марки АМг5, АМг6 с хорошей свариваемостью и марки В92, 1915, 1420.
Создание объектов космической техники
В этой области используют сплавы на основе алюминия, обладающие хорошей устойчивостью к низким температурам. Из марки 2219, способной работать при криогенных температурных условиях в контакте с жидким кислородом, гелием, водородом, изготавливались листы, применяемые при создании космических «Шаттлов». Из алюминиево-литиевой марки 2090 изготавливают емкости для жидкого водорода.
Судостроение
Алюминиевая промышленность изготавливает полуфабрикаты из алюминия и его сплавов для использования в судостроении. Из них производят судовое оборудование, корпуса судов, коммуникационные системы, надстройки для палубы. Применение этих материалов вместо стали уменьшает массу судна, улучшает его маневренность и максимально допустимую скорость. Чаще всего в этой отрасли востребованы магний- и марганецсодержащие марки.
Железнодорожный транспорт
Подвижной состав, эксплуатируемый на железной дороге, изготавливается только из прочных, износостойких, коррозионностойких, долговечных материалов. Такие свойства имеют алюминий и сплавы на его основе. Из них изготавливают емкости для перевозки сырой нефти, темных и светлых нефтепродуктов, масел.
Автомобильный транспорт
Сочетание небольшой плотности, прочности, декоративных характеристик и коррозионной устойчивости позволяет успешно использовать алюминиевые марки в автомобилестроении. Их применение расширяет ассортимент перевозимых товаров, среди которых могут быть жидкости и газы высоких классов опасности.
Применение алюминия в металлургии
Алюминий – высокоактивный металл, поэтому его используют в металлургии в качестве мощного восстановителя при производстве хрома, кальция, марганца. Для раскисления стали используется низкокачественный материал, не подходящий для производства полуфабрикатов и готовой металлопродукции. В ходе этого процесса из расплавленного железа удаляется кислород, негативно влияющий на эксплуатационные свойства конечного продукта.
Понятие о металлургии: общие способы получения металлов
Понятие о металлургии: общие способы получения металлов
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.

Например , железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.

Например , железо можно получить восстановлением из оксида с помощью угарного газа:
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:

Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.

1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Последовательность восстановления оксида железа (III):
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
CaO + SiO2 → CaSiO3
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Металлургия алюминия
Извлечение глинозема из руды осуществляется различными методами в зависимости от конкретного состава руды. При большом содержании оксида серы Si02 используют кислотные, электрохимические и некоторые другие методы, при малом — глинозем получают щелочным методом, суть которого состоит в следующем. Мелкораз- молотую руду обрабатывают раствором едкого натра в автоклаве при температуре 250 °С и давлении 2,5. 3,0 МПа. Гидрооксиды алюминия, содержащиеся в руде, при таких условиях быстро и достаточно полно растворяются в щелочи с образованием алюмината натрия NaAl02. Пустая порода, не растворившаяся в щелочи, выпадает в осадок (красный шлам). Раствор алюмината в виде пульпы сливается из автоклава в стальные емкости, где при длительном и медленном перемешивании и постепенном охлаждении из него выпадает кристаллический гидрооксид алюминия А1(ОН)3. Эта операция длится 50. 70 ч. Кристаллический гидрооксид после промывки и фильтрации подвергается обжигу (кальцинации) в трубчатых печах при температуре 1200 °С. Гидрооксид, теряя воду, превращается в чистый глинозем.
Для самой богатой алюминиевой руды — боксита, содержащего до 50 % глинозема А123, чаще всего применяется мокрый щелочной метод извлечения алюминия. Вначале бокситы прокаливают в проходных трубчатых печах (рис. 2.19, а) и измельчают в мельницах (рис. 2.19, 6), после чего загружают в автоклав (рис. 2.19, в) для выщелачивания при температуре
200 °С и давлении 3 МПа. При этом протекает реакция образования растворимого в воде алюмината натрия:

Паралелыю происходит образование нерастворимого в воде Na2Q • Л123 • 2SiQ2 • 2Н20. Чем выше содержание оксида кремния
Si02 в боксите, тем больше необратимые потери глинозема А123 и гидроксида натрия NaOH. Пульпа после фильтрации (рис. 2.19, г) охлаждается, в результате этого выпадает в осадок гидрооксид алюминия:

Вода отделяется от гидроксида алюминия А1(ОН)3 фильтрованием (рис. 2.19, Э), после чего гидрооксид алюминия обезвоживают нагреванием в печах (рис. 2.19, е) и затем подают в электролизные ванны (рис. 2.19, ж), где путем электролиза глинозема в расплавленном криолите Na2AlF6 получают алюминий. Сварные стальные ванны 3 футерованы изнутри угольными блоками, а у стенок — шамотным кирпичом 1, стальные катодные шины 4 вмонтированы в футеровку, благодаря этому угольный слой футеровки является катодом (-). Анодами 5 (+) служат самообжигающиеся угольные электроды, которые по мере обгорания снизу наращиваются сверху анодной массой, отвердевающей в результате коксования. Температура электролита 2 составляет -950 °С. Глинозем, расходуемый в ходе электролиза, загружается в ванну сверху, для чего твердая корка электролита переодически проламывается. При этом происходит удаление углекислого газа С02. Растворенный в электролите глинозем диссоциирует на ионы: Л123 = = 2А1 +++ + 30 . На поверхности катода ионы алюминия восстанавливаются до металла: 2Л1 +++ + 6е = 2Л1, который собирается па дне ванны 3 и периодически удаляется через металлическую летку. Кислородные ионы разряжаются на угольном аноде 5 и при взаимодействии с ним образуют углекислый газ С02.
Более чистый алюминий получают повторным электролизом (рис. 2.19, з) через расплав хлористых и фтористых солей 6, подобранных таким образом, чтобы их плотность была выше 27 г/см 3 . В рафинированный алюминий для увеличения плотности добавляют медь 7. При этом анодом 8 является угольная ванна, а катодом 9 — угольный электрод. В расплавленном электролите алюминий подвергается анодному растворению и электролизу, скапливаясь в верхней части ванны как более легкий компонент. В ходе электролиза он очищается не только от неметаллических включений, но и от металлических примесей. Таким образом, готовый продукт содержит 99,99 % Л1.
Полученный в электролизной ванне алюминий загрязнен примесями кремния, железа, неметаллическими включениями и газами (прежде всего водородом) и требует рафинирования. Для очистки от газов и неметаллических включений расплав алюминия продувается

Рис. 2.19. Схема технологического процесса получения алюминия из бокситов хлором (рис. 2.19, и). Пузырьки хлора С^и хлорида алюминия AICI3, при температуре жидкого алюминия представляющие собой соединения парообразного вида, растворяют водород и адсорбируют на своей поверхности включения, вынося их в верхние слои расплава и в атмосферу.
В производстве алюминия на 1 т глинозема расходуется около 2,5 т бокситов и до 200 кг щелочи. Выход глинозема из алюминатного раствора около 80 %, а расход энергии приблизительно 2 кВт • ч/т. Производительность электролизеров определяется силой тока: при ее величине 50 кА в сутки выделяется около 350 кг алюминия, выход по току составляет около 90 %.
На получение 1 т алюминия затрачивается 2 т глинозема, 0,1 т криолита и 16 500. 18 500 кВт • ч электроэнергии.
Принцип цифровой маркировки алюминиевых сплавов:


