Как получить медь в домашних условиях?
Как произвести плавку меди в домашних условиях пошаговая инструкция.
Предметы из меди широко используются как в промышленности, так и в хозяйстве. Вполне естественно, что у многих мастеров может появиться вопрос о том, как же наладить процесс выплавки и литья медных изделий в условиях дома или гаража. Технология выплавки меди известна очень давно и позволяет выплавлять изделия из сплавов — латуни и бронзы. О том, как выполняется плавка меди в домашних условиях, пошаговая инструкция расскажет подробно.

Медь — пластичный металл красноватого цвета. Такой цвет обусловлен наличием оксидной пленки на ее поверхности из-за взаимодействия с воздухом. Хорошо обрабатывается методом ковки и легко плавится.
- Также этот металл обладает такими свойствами, как электропроводность и теплопроводность, благодаря чему активно используется в электротехнике и некоторых других областях.
- Еще одно важное свойство меди — относительно невысокая температура плавления, что оказывает влияние на количество энергозатрат. Чистый металл плавится при температуре 1083 °С, если же добавить в сплав олово, то получится бронза, имеющая температуру плавления уже от 930 °C. При добавлении цинка получится латунь, которая переходит в жидкое состояние при температуре от 900 °C.
- При подборе лома для переработки следует учитывать, что самая чистая медь — электротехническая. При переработке сплавов из бронзы или латуни нужно знать, что старинные изделия из этих металлов могут содержать высокие концентрации мышьяка, это может не лучшим образом сказаться на вашем здоровье.
Пошаговая инструкция по выплавке меди
Если вы приняли решение организовать техпроцесс по плавлению металла в домашних условиях, в первую очередь, вам следует знать температуру кипения меди. Она составляет 2650°C. При этой температуре металл начинает кипеть и пузыриться. Изделие, отлитое при такой температуре, будет иметь высокое количество пор, что негативно скажется как на его механических, так и на декоративных свойствах.
Если правильно подготовить оборудование и организовать процесс плавки, то в домашних условиях можно получить качественные изделия как для технического, так и для бытового и декоративного применения.

Для организации техпроцесса понадобятся следующее оборудование и расходные материалы:
- форма, в которую будет заливаться металл;
- газовая горелка;
- горн;
- уголь древесный;
- крюк из железной проволоки;
- пылесос со шлангом;
- щипцы железные (для извлечения тигля из печи);
- тигель для выплавки металла (обычно для таких целей используются керамические или глиняные тигли);
- муфельная печь.
Последовательность действий
Выплавка может проводиться несколькими способами:
- Выплавка с помощью муфельной печи. Металл измельчают на кусочки. Чем мельче используются кусочки, тем быстрее будет происходить плавка. Кусочки засыпаются в тигель, который после заполнения помещается в печь. Печь предварительно разогревается до нужной температуры. В печах, изготовленных серийным способом, предусмотрено окно, через которое ведется наблюдение за процессом выплавки. После расплавления металла тигель извлекается из муфельной печи с помощью стальных щипцов. На поверхности жидкой меди находится пленка из окиси. Ее необходимо сместить стальным крюком к краю тигля. После этих действий медь аккуратно, но быстро заливается в заранее приготовленную форму.
- Выплавка с помощью газовой горелки. Если тигельной печи в вашем распоряжении не имеется, вместо нее вполне подойдет газовая горелка. Ее следует расположить под дном емкости с металлом, следя за тем, чтобы пламя охватывало всю поверхность днища тигля. При таком способе металл будет быстро окисляться из-за открытого доступа воздуха. Чтобы этого избежать, можно насыпать в емкость слой размельченного древесного угля.
- Выплавка с помощью паяльной лампы. Этот способ больше подходит для работы с более легкоплавкими сплавами на медной основе. Процесс проходит так же, как и с газовой горелкой.
- Выплавка с помощью горна или домашнего пылесоса. В этом случае емкость с металлом помещается на слой горящего древесного угля. Такую печь можно выложить из огнеупорного кирпича. Для создания подходящей температуры нужно организовать поддув воздуха. Это можно сделать двумя способами — используя горн или бытовой пылесос. При использовании пылесоса будет необходимо изготовить металлический переходник с соплом меньшего диаметра.

Чистая медь не обладает достаточно хорошей текучестью для изготовления сложных изделий. Для подобных целей лучше пользоваться латунью, причем следует иметь в виду — чем светлее сплав, тем ниже температура его плавления.
Как различать основные медные сплавы
Оптимальный метод для точной идентификации металла — спектральный анализ. Однако, для его проведения необходимы сложные дорогие приборы. Если нужно отличить меди своими силами, приходиться обходиться подручными средствами.
Металлическая медь имеет три отличительные особенности: характерный окрас, высокая пластичность и устойчивость к коррозии. Антикоррозийные свойства обусловлены тончайшим слоем оксида, покрывающим поверхность металла. Такая пленка обеспечивает химическую инертность материала и изменяет свет изделия.
Как идентифицировать медь на глаз?
Зрительный метод самый доступный, хотя и не всегда действенный. Сходную с медью окраску имеют такие металлы:
- золото с прмесями;
- цезий с примесями;
- осмий с примесями;
Другие окрашены в серые тона, и потому несложно отличить медь от большинства металлов.
Чистая медь имеет розовато-красный цвет. Рассматривать изделие нужно при дневном освещении, иначе предмет может казаться желто-зеленым.
Важный момент: необходимо предварительно удалить слой оксида, имеющий голубовато-зеленый оттенок.
Некоторые сложности могут возникнуть с медными сплавами — латунью и бронзой, а также с алюминием, обогащенным медью.
Как отличить медь от латуни
Латунь — сплав меди и цинка, содержание которого колеблется от 4 до 45%. При существенной доле цинка окраска латуни становится желтоватой. Если же цинка менее 10%, визуальный метод не поможет. В такой ситуации существует 3 решения:
- Акустический метод. При ударе медь издает приглушенный звук, латунь — звонкий. Необходим тонкий слух. Такой способ хорош для крупногабаритных объектов.
- Механический метод. Медь пластична и, в отличие от латуни, легко гнется.
- Взвешивание. Цинк и его сплав легче меди. При низком содержании цинка и для мелких предметов потребуются точные весы. Плотность меди составляет 9 г/см3, цинка — 7,1 г/см3, плотность латуни зависит от ее состава, но всегда ниже, чем у чистого металла.
Имеются и другие методы. Например, если есть возможность снять стружку. У меди она имеет спиралевидную форму, тогда как у латуни она прямая, игольчатая.
Еще один способ несколько сложнее, поскольку для него потребуется соляная кислота. Медь не вступает в реакцию с этим реагентом, а латунь реагирует с образованием хлористого цинка, образующего беловатый налет.
Как отличить медь от бронзы
Бронза — сплав меди с оловом. Она окрашена почти также, как чистая медь. Визуальный метод окажется в такой ситуации малоэффективным. Самый распространенный способ идентификации основан на высокой пластичности меди. Надавливание твердым предметом на медное изделие приведет к образованию вмятины. Бронза значительно прочнее. Такой способ подойдет для лома или изделий технического назначения. Но не всегда допустимо оставлять дефекты на предмете.
Для другого способа потребуется раствор поваренной соли, которая всегда имеется в хозяйстве. Приготовьте раствор из расчета 200 г соли на 1 л воды и разогрейте до 50 град. или чуть выше. Погрузите в него исследуемое изделие и продержите там четверть часа. Бронза останется инертной, тогда как медь поменяет окраску.
Еще одна методика — патирование. Это процесс образования оксидной пленки в естественных условиях. Старая медная вещь уже покрыта голубовато-зеленым налетом, а только что выпущенная или зачищенная неизбежно покроется им в течение некоторого времени. Бронза же не патируется.
Как отличить медь от алюминия
Чистые металлы легко различить по цвету. Однако, довольно часто возникает необходимость идентифицировать луженую медь, имеющую серебристую окраску, или обогащенный медью алюминий, имеющий желтоватый цвет. Оба сплава используются для изготовления кабеля, а в некоторых случаях важно знать, из чего он сделан. В такой ситуации зрительный анализ не даст результата.
Проще всего измерить сопротивление. У стометрового медного провода эта величина составляет 4 — 8 Ом, тогда как у алюминиевого — порядка 12 — 20 Ом. Достоинства такой методики в том, что кабель не повреждается.
Другой способ основан на разной прочности на изгиб. Если несколько раз согнуть и разогнуть алюминиевую жилу, она сломается, а медная выдержит такое испытание.
Наконец, можно подержать кабель в огне. Алюминий плавится уже при 600 град., медь — при значительно более высокой температуре. Необходимо понимать, что при нагревании, особенно на открытом огне, медь быстро покроется оксидной пленкой и изменит окраску. Этим можно пользоваться, чтобы отличить медь и от других сплавов.
Еще один универсальный способ — воздействие азотной кислотой. Аккуратно капните реактивом на изделие. Металлическая медь в зоне контакта окрасится в сине-зеленый цвет.
Самый простой способ
Перед тем, как начинать какие-либо испытания, внимательно осмотрите предмет. Современные изделия чаще всего маркируются. Так можно совершенно безошибочно определить не только материал, но и марку
Как добывают медь: способы, история и месторождения
Медь сегодня — металл необыкновенно востребованный и широко применяющийся как в быту, так и в промышленности. В природе Cu можно встретить как в чистом состоянии, так и в виде руды. Способов добычи и получения меди из исходных горных пород существует несколько. При этом все они используются в промышленности достаточно широко. О том, как добывают медь, и пойдет речь в статье.
Немного истории
В какой местности медь в древние времена начала добываться и использоваться человеком впервые, археологам, к сожалению, выяснить не удалось. Однако доподлинно известно, что именно этот металл люди начали обрабатывать и применять в повседневной жизни самым первым.
 Вам будет интересно: Железо сернокислое: состав, формула, свойства, назначение и применение
Вам будет интересно: Железо сернокислое: состав, формула, свойства, назначение и применение

Известна медь человеку стала еще в каменном веке. Некоторые найденные археологами самородки этого металла несут на себе следы обработки каменными топорами. Первоначально люди использовали медь в основном только в качестве украшений. При этом применял для изготовления таких изделий человек в древние времена исключительно найденные им самородки этого металла. Позднее люди научились обрабатывать и содержащую медь руду.
 Вам будет интересно: Коррозия меди и ее сплавов: причины и способы решения проблемы
Вам будет интересно: Коррозия меди и ее сплавов: причины и способы решения проблемы
Представление о том, как добывают Cu и как его обрабатывают, имели многие народы древности. Подтверждений тому археологами было найдено множество. После того как человек научился делать сплавы меди с цинком, начался бронзовый век. Собственно само название «медь» придумали когда-то древние римляне. В эту страну такой металл привозили в основном с острова Кипр. Поэтому римляне и назвали его aes cyprium.
Как добывали медь в древности
Поскольку металл этот в быту человеком когда-то использовался очень широко, технологии его добычи были, конечно же, разработаны достаточно совершенные. Наши предки получали медь в основном из малахитовых руд. Смесь такого материала и угля помещали в глиняный сосуд и ставили в яму. Далее массу в горшке поджигали. Выделявшийся в результате угарный газ восстанавливал малахит до меди.
Запасы в природе
 Вам будет интересно: «Ямаха» 3 л. с. отзывы: отзывы реальных покупателей, инструкция, плюсы и минусы лодочного мотора
Вам будет интересно: «Ямаха» 3 л. с. отзывы: отзывы реальных покупателей, инструкция, плюсы и минусы лодочного мотора
Где можно добыть медь в дикой природе сегодня? На настоящий момент залежи этого популярного металла открыты на всех континентах Земли. При этом запасы Cu считаются практически неограниченными. Геологи в наше время находят все новые месторождения чистой меди, а также содержащих ее руд. К примеру, в 1950 г. мировые резервы этого металла составляли 90 млн тонн. К 1970 г. этот показатель уже увеличился до 250 млн т, а к 1998 г — до 340 млн т. На настоящий момент считается, что запасы меди на планете составляют более 2.3 млрд тонн.
Месторождения и способы добычи чистой меди
Как уже упоминалось, изначально человек использовал в быту самородный Cu. Конечно же, добывается такая чистая медь и в наши дни. Образуются самородки этого металла в земной коре в результате экзогенных и эндогенных процессов. Самое большое известное месторождение самородной меди на планете на данный момент находится в США, в районе озера Верхнее. В России самородная медь залегает в Удоканском месторождении, а также в некоторых других местах Забайкалья. Кроме того, ответом на вопрос о том, где можно добывать медь в России в виде самородков, является и уральский регион.

В природе чистый металл этой разновидности образуется в зоне окисления медносульфатных залежей. Обычно в самородках собственно самой меди содержится около 90-99%. Остальное приходится на другие металлы. В любом случае ответом на вопрос о том, как добывают медь самородную, служат две основных технологии. Разрабатывают такие месторождения, как и рудные, закрытым шахтным или открытым карьерным способом. В первом случае при этом используют такие технологические процессы, как бурение и отбойка.
Весить медные самородки могут очень много. Самые большие из них когда-то были найдены на озере Верхнем в США. Вес этих самородков составлял около 500 т.
Где добывают медь в России, мы выяснили. В основном это Забайкалье и Урал. В нашей стране, конечно же, также в разные времена находили очень крупные самородки этого металла. К примеру, медные куски весом до нескольких тонн часто находили на Среднем Урале. Один из таких самородков в 860 кг ныне храниться в Санкт-Петербурге, в музее Горного института.
Медные руды и их месторождения
 Вам будет интересно: «Мастер Мебель»: отзывы покупателей о качестве и разнообразии продукции
Вам будет интересно: «Мастер Мебель»: отзывы покупателей о качестве и разнообразии продукции
На настоящий момент получать Cu считается экономически выгодным и целесообразным даже в том случае, если его содержится в породе хотя бы 0.3%.
Чаще всего для выделения меди промышленным способом в природе в наши дни добывают следующие породы:
борниты Cu5FeS4 — сульфидные руды, называемые по-другому медным пурпуром или пестрым колчеданом и содержащие около 63.3% Cu;
халькопириты CuFeS2 — минералы, имеющие гидротермальное происхождение;
халькозины Cu2S, содержащие более 75% меди;
куприты Cu2O, часто встречающиеся также и в местах залежей самородной меди;
малахиты, представляющие собой углекислую медную зелень.
Самое большое месторождение медных руд в России находится в Норильске. Также такие породы в больших количествах добывают в некоторых местах на Урале, в Забайкалье, на Чукотке, в Туве и на Кольском полуострове.

Как разрабатывают залежи медных руд
Разного рода породы, содержащие Cu, как и самородки, могут добываться на планете по двум основным технологиям:
В первом случае на месторождении строятся шахты, протяженность которых может достигать нескольких километров. Для перемещения рабочих и техники такие подземные туннели оснащаются лифтами и железнодорожными путями. Дробление породы в шахтах производится с использованием специального бурового оборудования, имеющего шипы. Забор медной руды и ее погрузка для отправки наверх осуществляются с применением ковшей.
Если залежи находятся не далее 400-500 м от поверхности земли, их добыча ведется открытым методом. В этом случае на месторождении сначала снимается пласт верхней породы с использованием взрывных устройств. Далее постепенно вынимается собственно сама медная руда.

Способы получения металла из пород
Как добывают медь, а вернее, содержащие ее руды, мы, таким образом, выяснили. Но как же на предприятиях в последующем получают собственно сам Cu?
Основных способов выделения меди из горных пород существует три:
Пирометаллургический флотационный метод
Эта технология обычно используется для выделения меди из тех пород, в которых Cu содержится 1.5-2%. Такой материал подвергают обогащению флотационным методом. При этом:
руду тщательно размалывают до самого мелкого порошка;
смешивают полученный материал с водой;
добавляют в массу специальные флотореагенты, представляющие собой сложные органические вещества.
Флотореагенты покрывают мелкие крупинки разных соединений меди и передают им несмачиваемость.
На следующем этапе:
в воду добавляют вещества, создающие пену;
пропускают через взвесь сильный поток воздуха.
Легкие сухие частички соединений меди в результате прилипают к воздушным пузырькам и всплывают наверх. Содержащую их пену собирают, отжимают от воды и тщательно просушивают. В результате и получают концентрат, из которого затем выделяют черновой Cu.

Как добывают медь из руды: обогащение методом обжига
Флотационный метод используется в промышленности достаточно часто. Но иногда для обогащения медной руды применяется и технология обжига. Такая методика чаще всего используется для руд, содержащих большое количество серы. В данном случае материал предварительно нагревается до температуры 700-8000 °С. В результате происходит окисление сульфидов с уменьшением в породе содержания серы.
На следующем этапе подготовленную таким образом руду расплавляют в шахтных печах при температуре в 14500 °С. В конечном итоге при использовании такой технологии получают штейн — сплав меди и железа. Далее это соединение улучшают путем обдувки в конвертерах. В результате оксид железа переходит в шлак, а сера — в SO4.
Получение чистой меди: электролиз
При использовании методов флотации и обжига получают черновую медь. Собственно Cu такой материал содержит около 91%. Чтобы получить более чистую медь, черновую в дальнейшем подвергают рафинированию.
В данном случае из первичной меди сначала отливают толстые пластины-аноды. Далее:
набирают в ванну раствор медного купороса;
подвешивают в ванной пластины-аноды;
в качестве катодов используют тонкие листы из чистой меди.
Во время реакции электролиза на анодах происходит растворение меди, а на катодах — осаждение. Ионы меди продвигаются к катоду, забирают у него электроны и переходят в атомы Cu+2+2e?>Cu.

Примеси, содержащиеся в черновой меди, при очистке могут вести себя по-разному. Цинк, кадмий, железо растворяются на аноде, но не оседают на катоде. Дело в том, что в ряду электрохимического напряжения они находятся левее меди, то есть имеют более отрицательные потенциалы.
Медный купорос получают медленным окислением сульфидной руды кислородом до сульфата меди CuS + 2O2 > CuSO4. В последующем соль выщелачивается водой.
Гидрометаллугический способ
В данном случае для выщелачивания и обогащения меди используется серная кислота. В результате реакции при применении такой технологии получают раствор, насыщенный Cu и другими металлами. Из него затем и выделяют медь. При использовании такой методики, помимо черновой меди, можно получать и другие металлы, включая драгоценные. В любом случае применяется эта технология чаще всего для выделения Cu из не слишком богатых на него пород (менее 0.5%).
Медь в домашних условиях
Выделение этого металла из насыщенных им руд — дело, таким образом, технологически относительно несложное. Некоторые поэтому интересуются тем, как добыть медь в домашних условиях. Получить этот металл из руды, глины и пр. своими руками, без наличия специального оборудования, будет, однако, очень сложно.

Некоторые, к примеру, интересуются тем, как добыть медь из глины своими руками. Ведь в природе существуют залежи этого материала, богатого в том числе и на Cu. Однако, к сожалению, известных проверенных технологий получения в домашних условиях меди из глины, не существует.
Своими руками этот металл дома можно попробовать выделить, пожалуй, только из медного купороса. Для этого последний нужно сначала растворить в воде. Далее в полученную смесь следует просто поместить какой-нибудь железный предмет. Через некоторое время последний — в результате реакции замещения — покроется медным налетом, который в дальнейшем можно будет просто счистить.
Получение меди
Медь или купрум, названа так в честь острова Кипр, где нашли крупное ее месторождение. Это один из первых металлов, освоенных человеком. Медный век – удивительная эпоха, в которую обиход человека был наполнен медными орудиями и предметами быта, он продолжался с IV до III тысячелетия до н. э.
Способы получения меди
Для извлечения меди из минералов и руд, в которых она находится, на сегодняшний день используют три метода:
- гидрометаллургический
- пирометаллургичекий
- электролиз.
Получение меди пирометаллургическим методом является наиболее распространенным. Сырьем для этого процесса выступает халькопирит. Чтобы получить из халькопирита чистую медь, необходимо осуществить ряд операций. Первая, из которых, заключается в обогащении медной руды, методом окислительного обжига или флотации.
В основе флотации лежит тот факт, что пустая порода и ее медесодержащие части, смачиваются по-разному. Если поместить всю массу породы в емкость с жидким составом, в котором имеются воздушные пузырьки, то часть с минеральными элементами, перемещается при помощи этих пузырьков на поверхность, и прилипает к ним. В результате на поверхности ванны наблюдается наличие концентрата или черновой меди. В этом составе присутствует от 10 до 35% чистой меди. Этот порошкообразный концентрат является сырьем для дальнейшего получения чистой меди.
Совсем по-другому протекают реакции получения меди методом окислительного обжига. Этим методом обогащают медные руды, в составе которых имеется существенное количество серы. Для реализации этой технологии необходимо нагреть руду до температуры 700–8000 градусов. Под действием таких высоких температур происходит окисление сульфидов, и объем серы в медной руде снижается почти в два раза. Следующим этапом является расплавление обогащенной руды в отражательных или шахтных печах при температуре 14500. Результатом этого расплава является образование штейна – сплава, который состоит из сульфидов меди и железа.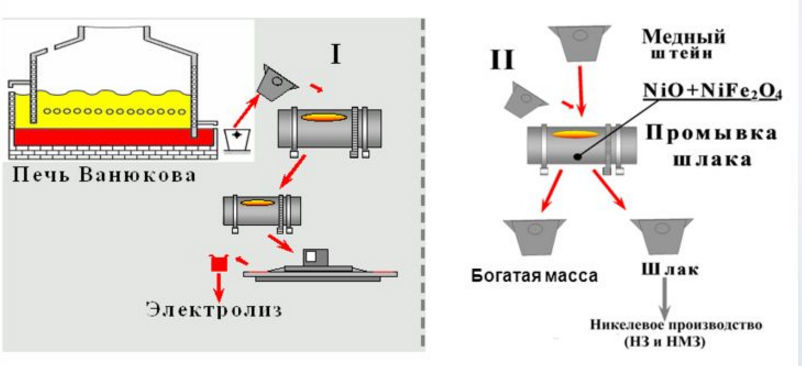 Чтобы улучшить показатели штейна его подвергают обдуванию в горизонтальных конвертерах без добавления дополнительного топлива. Таким образом, железо и сульфиды окисляются, оксид железа превращается в шлак, а сера становится оксидом – SO2.
Чтобы улучшить показатели штейна его подвергают обдуванию в горизонтальных конвертерах без добавления дополнительного топлива. Таким образом, железо и сульфиды окисляются, оксид железа превращается в шлак, а сера становится оксидом – SO2.
Черновая медь, полученная таким способом, имеет в своем составе около 91% меди. Для дополнительной очистки металла выполняется рафинирование меди, то есть удаление посторонних примесей. Это осуществляется благодаря технологии огневого рафинирования в присутствии подкисленного раствора медного купороса. Это рафинирование меди носит электролитический характер, и дает возможность получить металл с чистотой 99,9%.
Гидрометаллургический метод обогащения меди основан на процессе выщелачивания металла с помощью серной кислоты. Результатом такого процесса является получение раствора, из которого в дальнейшем выделяют чистую медь. Также этот метод подходит для выделения драгоценных металлов. Эту технологию применяют для обогащения руд, в которых присутствует крайне малое количество меди.
Получение меди электролизом
Электролиз меди является одним этапов химико-физических процессов, которому подвергают руду, чтобы получить медь. Примечательно, что для получения 1 тонны чистой меди, потребуется переработать как минимум 200 тонн медной руды.
Сама процедура обработки медной руды – это многоступенчатый и очень сложный процесс, который состоит из 7 стадий. Самой последней и является электролиз меди.
Руду после добычи необходимо измельчить в особых машинах. Далее происходит процесс флотации, в результате которого, как мы знаем, формируется концентрат с сохранением минералов меди. После этого происходит обжиг при высоких температурах в специальных печах. Шихту, полученную в процессе обжига, помещают в печь для плавки, где она становится штейном, который в свою очередь оправляют на конвертирование. Продукт, полученный после этих процессов, называют черновой медью, где 2-3% объема занимают примеси. В качестве примесей выступают цинк, железо, или сера. Их удаляют реакцией окисления. На этом этапе образуется «красная» медь, в которой присутствует 99,7-99,9% Cu. Последним этапом является непосредственно электролиз меди, который позволяет добиться получения максимально чистой меди.
Чтобы осуществить процесс электролиза меди понадобится специальное оборудование, а именно емкости, которые заполняют водным раствором сульфата меди с содержанием свободной серной кислоты. В результате проведения электролиза, мы получим осадок чистой меди на катодах. А все, что окажется на дне ванны, принято называть шламом. Он является сырьем для получения благородных металлов.
Получение оксида меди
Оксид меди (II) CuO представляет собой кристаллы черного цвета, которые подвергаются кристаллизации в моноклинной сингонии. Плотность соединения составляет 6,51 г/см3, а плавится он при температуре 1447°С в условиях высокого давления. В результате нагревания до 1100°С является выделение оксида меди (I):
В воде оксид меди не растворяется и не вступает в реакции с ней. Обладает слабыми амфотерными свойствами с преобладанием основных.
С водными растворами аммиака реагирует с образованием гидроксида тетраамминмеди (II):
Также легко вступает в реакции с разбавленными кислотами с выделением соли и воды:
Результатом сплавления оксида меди со щелочами является образование купратов:
Чистую медь из оксида можно получить методом восстановления водородом, угарным газом и активными металлами:
- CuO + H2 = Cu + H2O
- CuO + CO = Cu + CO2
- CuO + Mg = Cu + MgO.
Реакция получения оксида меди методом прокаливания гидроксида меди (II) при температуре 200°С:
Также получить оксид меди можно в процессе окисления металлической меди на воздухе при температуре 400–500°С:
Получение сульфата меди
Получить сульфат меди можно тремя реакциями:
растворить CuO в H2SO4
в присутствии концентрированной серной кислоты с медью, обязательно при нагревании
методом взаимодействия Cu2O с разбавленной серной кислотой
Получение хлорида меди
В природе хлорид меди находится в составе очень редкого минерала эрнохальцита CuCl₂•2H₂O, который представляет собой кристаллы синего цвета.
Двухвалентный хлорид меди обладает важным практическим значением, и добычи его только лишь из природного минерала очень мало. Поэтому ученые придумали несколько способов искусственного получения данного соединения.
Главной реакцией промышленного синтеза CuCl₂ можно назвать реакцию хлорирования сульфида меди в условиях высокой температуры от 300 до 400 градусов °С. Выглядит реакция так
- CuS + Cl₂ ―› CuCl₂ + S
Еще одним вариантом синтеза хлорида двухвалентной меди является хлорирующий обжиг, который осуществляется при температуре более 500 С:
- CuS + 2NaCl + 2O₂ ―› CuCl₂ + Na₂SO₄
Обе реакции нуждаются в использовании специализированного оборудования и соблюдении повышенных мер безопасности, по этой причине данные реакции можно проводить только в условиях промышленного производства. В лабораторных условиях также можно получить хлорид меди следующими реакциями
- Cu + Cl₂ ―› CuCl₂
- CuO + 2HCl ―› CuCl₂ +H₂O
- Cu(OH)₂ + 2HCl ―› CuCl₂ + 2H₂O. Реакция нейтрализации
- CuCO₃ + 2HCL ―› CuCl₂ + H₂O + CO₂. В результате этой реакции более сильная кислота вытеснит кислотный остаток более слабой кислоты. Протекает реакция замещения
- 3Сu + 2HNO₃ + 6HCl ―› 3CuCl₂ + 2NO +4H₂0. Эта реакция является наиболее оригинальной. Она протекает только в присутствии смеси двух сильных кислот.
Получение глицерата меди
Качественная реакция для выявления присутствия глицерина в растворах осуществляется в присутствии сульфата меди (II) и раствора гидроксида натрия. В результате реакции образуется глицерат меди – комплексное соединение сине-василькового оттенка.
Химическую реакцию проводят следующим образом:
- к раствору сульфата меди (II) приливают раствор гидроксида натрия, в результате чего происходит окрашивание раствора в синий цвет. Таким образом, наблюдаем выпадения осадка гидроксида меди (II)
- после этого добавляем несколько мл глицерина и перемешиваем раствор. Образовавшийся осадок растворяется с образованием комплексного соединения оттенка индиго. Это и есть глицерат меди.
Получение нитрата меди
Получение нитрата меди Cu(NO3)2 довольно увлекательное занятие. А также очень полезное, поскольку он является довольно популярным красителем. Нитрат меди (II) можно получить в процессе растворения чистой меди, ее оксида или гидроксида в азотной кислоте. Уравнения выглядят следующим образом:
Получение сульфида меди
Сульфид меди(II) или моносульфид меди — CuS, является неорганическим бинарным соединением двухвалентной меди с серой. Он верного цвета, в воде не растворяется , также как и в разбавленных растворах кисло. В природе его можно встретить в виде редкого минерала ковеллина.
Получение сульфида меди осуществляется при помощи прямого взаимодействия элементов, а также в результате обменной реакции солей двухвалентной меди с водорастворимыми сульфидами.
- Na2S+CuSO4=CuS+Na2SO4
- CuCl2 + H2S —> CuS + 2HCl
- 2CuS + H2 —>Cu2S + H2S. Эта реакция протекает в условиях высокой температуры от 600 до 700 oC
Получение сухим методом дает сульфиду меди возможность проводить электрический ток. Когда отметка термометра достигает 400 °C, наблюдается заметное разложение сульфида.
Покрытие металлов медью в домашних условиях
Меднение в домашних условиях: особенности покрытия, технология, электролиты и оборудование. Гальваническое покрытие медью с погружением и без погружения. Рецепты домашних электролитов. Техника безопасности и утилизация химикатов.

При меднении в домашних условиях используются доступные и недорогие материалы, которые легко приобрести в магазинах розничной торговли.
Медный купорос используется для борьбы с плесенью, грибком и садовыми вредителями и свободно продается в хозяйственных магазинах, а в качестве анодов можно использовать короткие отрезки медных труб или электротехнических шинок.
Меднение металла домашними мастерами, в основном, производится в декоративных целях, в том числе для покрытия мебельной фурнитуры, столовых приборов, металлических частей люстр, бижутерии и пр. При выполнении определенных условий гальваническое покрытие медью можно выполнять и по органическим материалам.
Таким образом меднят высушенные цветы, орехи, листья и даже насекомых. Кроме того, во многих случаях обязательным условием для никелирования и хромирования является наличие подслоя меди, который также создается путем ее осаживания из электролита.
Цель меднения металлов и сферы их применения
Медь обладает совокупностью свойств, которые определяют условия ее применения при меднении металлов и неметаллических материалов. Она пластична, легко поддается полировке, а гальванический слой после меднения практически не имеет пор.
По этой причине медные покрытия очень часто используют в качестве подслоя при хромировании и никелировании изделий, которые эксплуатируются в условиях постоянных сжатий и растяжений. Пластичность меди является идеальным условием для ее применения в гальванопластике.
Толстослойное меднение художественных изделий и сложных моделей позволяет создавать их абсолютно точные копии, которые не трескаются и не деформируются при снятии с оригинала.
Медь обладает лучшей среди недрагоценных металлов электропроводностью и хорошо паяется. Поэтому меднение стальных изделий широко используется в радиотехнике и электротехнике при изготовлении проводников, контактов, деталей антенн и волноводов.
В условиях применения высокочастотных сигналов на медное покрытие приходится большая плотность тока (скин-эффект), что снижает общее сопротивление проводника.
Еще одна область использования меднения — это создание тонких проводников на поверхностях пластмассовых изделий, а также покрытие пластика токопроводящими слоями.
Характеристики омедненных металлов
Под воздействием атмосферных факторов оно достаточно быстро разрушается, и даже в домашних условиях его обычно покрывают лаком. В то же время подслой из меди значительно улучшает характеристики многослойных покрытий в части механической прочности и коррозионной стойкости.
Нержавеющие стали обычно защищают от коррозии трехслойным покрытием из хрома, никеля и меди. При этом меднение проводится первым, чтобы при использовании изделия в условиях переменных нагрузок обеспечить пластичность всего составного слоя.
Точно такую же роль меднение играет в покрытиях металлопроката и листового железа, из которых изготавливают профильные изделия, эксплуатируемые в условиях морского климата и агрессивных сред. Омедненные провода и контакты из алюминия легко паяются и имеют более низкое сопротивление, особенно на высоких частотах.
Технические условия электролиза позволяют при меднении металлов в декоративных целях окрашивать поверхностные слои меди в различные цвета и придавать им дополнительный блеск (на фото ниже – меднение по нержавейке).

Технология процесса меднения
В общем виде процесс гальванического меднения состоит из следующих этапов, которые в зависимости от технических условий могут быть дополнены другими видами обработки:
- механическая очистка (с помощью металлической щетки, шкурки и электроинструмента);
- промывка проточной водой;
- обезжиривание (химическое или электролитическое);
- промывка и сушка;
- проверка качества поверхностей;
- погружение изделия в электролит;
- подача тока и контроль процесса;
- промывка и сушка готового изделия.
Основой для подавляющего большинства электролитов является раствор медного купороса (сернокислой меди), в который в зависимости от условий обработки добавляют различные химические реагенты.
Технология гальванического меднения основана на использовании расходуемых анодов, которые служат источником анионов меди, осаждаемых в виде тонкого слоя на поверхности катода-изделия. В роли катодов выступают пластины меди любой чистоты.

Способы меднения металлов
С помощью химического метода нельзя получить покрытия большой толщины, но оно проще, дешевле и может выполняться в крайне простых условиях. С помощью него легко получить тонкие декоративные пленки не только на металлах, но и на пластике, стекле, керамике и пр.
К примеру, химическое меднение стали происходит за несколько десятков секунд путем простого погружения в медный купорос.
Погружение в электролитный раствор
Оба метода могут применяться с полным погружением детали в раствор электролита. При гальваническом методе анионы меди отрываются от анода и движутся к катоду под воздействием электрического тока, а при химическом их движение происходит за счет разной электроотрицательности металлов.
Поэтому в первом случае при прочих равных условиях за одну и ту же единицу времени осаждается гораздо большее количество меди, но при этом затрачивается электрическая энергия.
Меднение алюминия рекомендуется производить только методом погружения, которое необходимо выполнять сразу после обезжиривания и травления в кислоте, иначе на его поверхности быстро образуется прочная оксидная пленка.
В видеоролике ниже подробно рассказывается об условиях, которые необходимо соблюдать для качественного меднения алюминия.
Без помещения в электролитный раствор
В первом случае необходимо изготовить медную кисточку из обрезка кабеля с большим количеством мягких медных жил. Ее подсоединяют к плюсу источника, а минус подают на изделие. Затем, постоянно обмакивая кисточку в электролит, «красят» подготовленную поверхность, подбирая по ходу условия и скорость меднения.
Во втором варианте изделие просто покрывают раствором медного купороса с помощью малярной кисти, очищая и обмывая его после каждого слоя. Толщина обмеднения в этом случае будет небольшой и зависит от условий обработки и количества наложенных слоев.
Этот метод хорошо подходит для меднения стали, к которой медь «липнет» даже при условии не очень хорошей подготовки поверхности. А при нанесении таким способом медного купороса на поверхность алюминия достаточно сложно добиться устойчивого результата из-за его склонности к быстрому окислению.
Использование медного купороса
Если на медном купоросе садово-огородного назначения не указан состав, то для электролита он не годится, т. к. может содержать различные добавки, влияющие на гальванический процесс.
При приготовлении электролита в домашних условиях не следует применять сырую водопроводную воду, поскольку она содержит недопустимые при меднении соединения хлора. Перед использованием ее следует отстоять и прокипятить или же просто приобрести дистиллированную.
Гальваника медью в домашних условиях
В домашних условиях гальваническое меднение чаще всего используют в декоративно-прикладных целях или для нанесения медного подслоя перед никелированием и хромированием.
Обычно медью покрывают мебельную фурнитуру, предметы кухонной утвари, элементы светильников, бижутерию, а также части инструментов и ножей. Подбор параметров гальванизации домашними мастерами обычно делается опытным путем по цвету и качеству покрытия.
Те, кто занимается меднением серьезно, в том числе и в коммерческих целях, используют в своих установках регулируемые источники тока или реостаты, с помощью которых устанавливается необходимая плотность тока и скорость осаждения.
Для тех, кто не хочет возиться с самостоятельным подбором химических компонентов, интернет-магазины предлагают наборы для приготовления разнообразных электролитических растворов, в том числе и для меднения пластиков и органических материалов.
А одно из самых популярных направлений современной домашней гальваники — это покрытие медью высушенных растений, орехов, желудей и насекомых. Такие изделия выглядят впечатляюще и используются не только в декоративных целях, но и для изготовления бижутерии (см. ниже меднение и патинирование грецкого ореха).
Техника безопасности
Поэтому в домашних условиях все работы по приготовлению электролита и химической обработке изделия необходимо выполнять в резиновых перчатках и клеенчатом фартуке, а при больших объемах использовать респираторы и защитные очки.
Сам по себе медный купорос не требует какой-либо обработки перед утилизацией, но, поскольку электролиты на его основе содержат серную кислоту, ее необходимо нейтрализовать с помощью щелочи или соды.
Оборудование и материалы
Для меднения в домашних условиях требуется минимальный набор оборудования и реактивов. В качестве гальванической ванны можно использовать любую пластиковую или стеклянную емкость.
Для приготовления электролита для меднения необходим только медный купорос и чистая вода, а источником тока может служить старая зарядка для телефона или пара батареек. Другие материалы и инструменты также немногочисленны и доступны в бытовых условиях.
В первую очередь это серная кислота (жидкость для аккумуляторов), сода, обрезки медных изделий (труб, шинок, контактов) и наждачка на матерчатой основе.
Рецепт простого раствора
В состав самого простого электролита, используемого для меднения в домашних условиях, входят всего два реагента: сернокислая медь (медный купорос) в количестве 180÷220 г/л и серная кислота (жидкость для аккумулятора) — 40÷60 г/л. В качестве блескообразующих добавок к такому электролиту домашние мастера используют желатин и декстрин (0.5÷1.0 г/л).
В Интернете можно найти рецепты электролитов с добавками, которые способствуют созданию медных покрытий с разнообразными эффектами (матовость, зеркальный блеск, различные оттенки).
При этом, как правило, указывают только название химического вещества и условия его применения, а насколько оно доступно и где его взять — не пишут.
Если вы знаете названия таких добавок, которые можно свободно приобрести в хозяйственном магазине или аптеке, поделитесь, пожалуйста, информацией в комментариях к этой статье.


