При каких температурных условиях кристаллизуются чистые металлы?
ПЛАВЛЕНИЕ И КРИСТАЛЛИЗАЦИЯ ЧИСТЫХ МЕТАЛЛОВ
Плавление и кристаллизации вещества являются фазовым переходом первого рода и для чистых веществ плавление характеризуется определенной температурой, являющейся константой данного вещества.
Все металлы находятся в твердом состоянии до определенной температуры. Это значит, что до определенной температуры металл сохраняет свою кристаллическую структуру (решетку), в которой атомы, находящиеся в узлах кристаллической решетки, совершают колебательные движения с определенной амплитудой и частотой порядка 10 13 периодов в секунду. При нагреве амплитуда перемещения атомов в узлах кристаллических решеток увеличивается и, наконец, достигает такого значения, при котором силы взаимодействия между атомами не обеспечивают их взаимного положения в решетке, и она разрушается. Этот момент и называют плавлением, и вещество переходит в жидкое состояние.
Переход металла из жидкого или парообразного состояния в твердое с образованием кристаллической структуры называется первичной кристаллизацией. Образование новых кристаллов в твердом кристаллическом теле называется вторичной кристаллизацией. Кристаллы могут как самопроизвольно зарождаться — гомогенная кристаллизация, так и расти на уже существующих центрах кристаллизации — гетерогенная кристаллизация.
Плавление — процесс, обратный кристаллизации, — протекает при температуре выше равновесной температуры Тп, т.е. при перегреве. Разность реальной температуры кристаллизации и температуры плавления называется температурным гистерезисом. Термические кривые, характеризующие процесс кристаллизации чистых металлов при охлаждении с разной скоростью 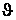 , показаны на рисунке
, показаны на рисунке
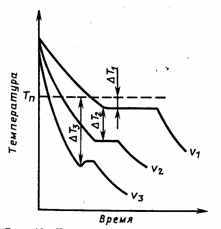
Рисунок 1 – Кривые охлаждения металла
при кристаллизации ( 1
1
Процесс роста кристалла заключается в присоединении к его зародышу все новых атомов металла из жидкой фазы. Момент равновесной температуры кристаллизации (Гп), когда равновероятно существование металла как в жидком, так и в твердом состояниях, т.е. число зародышей и скорость их роста равны нулю, и кристаллизация не происходит.
Полиморфные превращения. Данные превращения имеют место при вторичной кристаллизации, когда новые кристаллы образуются из твердой фазы. Полиморфизм — способность твердого металла при разных температурах или давлениях иметь две или несколько кристаллических структур, которые называются аллотропическими формами или модификациями. Низкотемпературную модификацию обычно обозначают буквой а, а высокотемпературные — соответственно буквами р у и т.д.
Железо имеет четыре полиморфные модификации: α-Fe, p-Fe, γ-Fe и 5-Fe. Практическое значение имеют модификации α -Fe и γ -Fe. Переход железа из одной модификации в другую происходит при определенных критических температурах. Модификация α -Fe имеет кубическую объемно-центрированную кристаллическую решетку, γ -Fe — кубическую гранецентрированную кристаллическую решетку. Переход железа из одной аллотропической формы в другую схематически показан на кривой охлаждения (рис. 19.6). В процессе охлаждения расплавленного железа при температуре 1535°С образуется площадка, характеризующая формирование кристаллической модификации 5-Fe; при температуре 1392°С происходит полиморфная модификация б-Fe в модификацию γ -Fe, которая при температуре 898°С переходит в модификацию P-Fe; при температуре 768°С модификация P-Fe переходит в модификацию α -Fe. Изучение этих четырех форм существования кристаллического железа показало, что в модификации γ -Fe имеется межатомное расстояние в кристаллической решетке, меньшее, чем в модификации p-Fe, и поэтому переход γ -Fe в P-Fe сопровождается увеличением объема кристалла. Отмечено, что модификация α -Fe обладает магнитными свойствами (ферромаг-нит), тогда как модификация (З-Fe этими свойствами почти не обладает, хотя кристаллические решетки их сходны между собой.
| | | следующая лекция ==> | |
| МЕХАНИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ | | | ПРОЦЕСС КРИСТАЛЛИЗАЦИИ СПЛАВОВ |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Кристаллизация чистых металлов.
При кристаллизации чистых металлов один из вариантов образования зоны термического переохлаждения связан с выделением Qк (рис. 1). После затвердевания некоторого объема металла выделившаяся Qк у ФК отводится как в твердую, так. и жидкую фазы. Последнее приводит к образованию пика на кривой действительной температуры (Тд) в районе ФК и появлению участка в жидкости с отрицательным градиентом температуры. В результате процесс кристаллизации останавливается, при этом возможно частичное оплавление уже закристаллизовавшейся твердой фазы. По мере отвода теплоты от удаляющегося сварочного источника температуры жидкой фазы на некотором расстоянии от ФК становится ниже Тпл, т. е. образуется
 Рис. 1. Кристаллизация чистых металлов в условиях термического переохлаждения:
Рис. 1. Кристаллизация чистых металлов в условиях термического переохлаждения:
а — окончание кристаллизации слоя; б — остановка процесса кристаллизации; в — кристаллизация нового слоя; Тпл и Тд — температуры плавления н действительная; Qк — теплота кристаллизации; хт — зона термического переохлаждения
зона термического переохлаждения (хт). После того как Тд на ФК станет равной или несколько ниже Тпл происходит быстрый рост твердой фазы на расстоянии хт. В дальнейшем также идет прерывистый рост твердой фазы с той же периодичностью. Величина хт зависит от Qк, градиента Тд, условий отвода теплоты от ФК и других факторов. По мере увеличения хт возможны плоский, ячеистый или дендритный типы первичной кристаллизации. На поверхности ФК всегда имеются микровыступы, обусловленные выходом под углом к его поверхности кристаллических плоскостей, обладающих тенденцией к преимущественному росту. При малом хт в период роста очередного слоя ФК остается «квазиплоским». При относительно большом хт происходит потеря устойчивости плоского ФК и кристаллизация идет путем развития и роста выступов. При развитии осей первого порядка, перпендикулярных к ФК, кристаллиты получают ячеистую микроструктуру, а при развитии также боковых осей второго порядка — дендритную. При плоском типе кристаллизации кристаллиты представляют собой монокристаллические образования, разграниченные друг от друга большеугловыми границами. При ячеистом типе кристаллизации кристаллиты представляют собой совокупность ячеек с гладкими сторонами, а при дендритном — совокупность древовидных участков, разграниченных малоугловыми границами (рис. 2). В чистых металлах первичная микроструктура (иногда называемая «субструктура») кристаллитов металлографически выявляется очень трудно. Ее можно фиксировать по рельефу на чистых поверхностях швов или на шлифах по различному селективному отражению элементов первичной микроструктуры. Наличие даже незначительного количества примесей, которые скапливаются на границах, существенно повышают степень выявляемости микроструктуры.
 Рис. 2. Кристаллизация сплавов в условиях концентрационного переохлаждения:
Рис. 2. Кристаллизация сплавов в условиях концентрационного переохлаждения:
Тлм — температура ликвидуса, Gж — градиенты прн различном распределении действительных температур; Со — исходная концентрация примеси в сплаве; Cж — распределение прнмесн в жидкой фазе у фронта кристаллизации (ФК); хк1, xк2 и хк3 — зоны концентрационного переохлаждения, соответствующие ячеистому, ячеистодендритному н дендритному типу кристаллизации
Кристаллизация металлов схема и процесс









Кристаллизация металлов
- Кристаллизация металла Энергетические условия кристаллизации любое вещество может находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Переход из одного состояния в другое происходит при определенной температуре, называемой температурой плавления, кристаллизации, кипения или сублимации. 40 этот переход осуществляется при определенных условиях (температура и давление). При атмосферном давлении, которое характерно для большинства производственных процессов, основным параметром перехода является температура.
В газах нет никакой регулярности в расположении частиц, частицы движутся хаотично, и газы стремятся занять как можно больший объем. Твердые кристаллические тела имеют правильную структуру, в которой атомы и ионы находятся в узлах кристаллической решетки (так называемый ближний порядок), а отдельные ячейки и блоки находятся определенным образом относительно друг друга. В жидкости определенная ориентация приходится не на весь объем, а на относительно устойчивую группу или небольшое число атомов, образующих флуктуации. При понижении температуры стабильность колебаний возрастает,
что свидетельствует о способности расти. Таким образом, жидкость характеризуется только близким порядком атомов. Людмила Фирмаль
По мере повышения температуры твердого тела подвижность атомов в узле решетки увеличивается, амплитуда колебаний увеличивается, и при достижении определенной температуры, называемой температурой плавления, температура плавления атома из узла является важной константой, и информация о ней содержится во всех справочниках: ртуть-38,9, температура плавления до температуры плавления нержавеющей стали 3410°C При охлаждении жидкости с последующим затвердеванием наблюдается обратная картина. При охлаждении жидкости, наоборот, подвижность атома уменьшается, и атом образуется ближе к точке плавления атома, заполняя его подобно кристаллу.
Эти группы являются центрами кристаллизации или зародышем, который впоследствии увеличивает слой кристаллов. При достижении температуры плавления-затвердевания кристаллическая решетка вновь формируется, и металл доводится до твердого состояния. Переход металлов из жидкого состояния в твердое при определенной температуре называется кристаллизацией. Рассмотрены термодинамические условия кристаллизации. Энергетическое состояние любой системы складывается из энергии движения молекул, атомов, электронов, ядерной энергии, энергии упругого изгиба кристаллической решетки и других видов энергии. Харрис 1.21 неравновесные (1), метастабильные (2)и стабильные (3)Положения шариков Свободная энергия — это такая составляющая внутренней энергии, которая может быть преобразована в работу в изотермических условиях.
- Свободная энергия изменяет свое значение за счет изменения температуры, плавления, полиморфных превращений и др.:F=U-TS, где F-свободная энергия, U-полная внутренняя энергия системы, T-температура, S-энтропия. Согласно второму закону термодинамики, каждая система стремится к минимуму свободной энергии. Самопроизвольно текущий процесс идет только в том случае, если новое состояние более стабильно, то есть запас свободной энергии меньше. Например, шар стремится скатиться вниз по наклонной плоскости, уменьшая при этом свою свободную энергию. Естественно, самопроизвольный возврат шара с наклонной плоскостью вверх невозможен, так как он увеличивает свободную энергию(рис. 1.21). Процесс кристаллизации подчиняется тем же законам.
Металл затвердевает, когда твердое тело имеет меньше свободной энергии и когда жидкое состояние имеет меньше свободной энергии. Изменение свободной энергии жидкости и твердого тела с изменением температуры показано на рисунке. 1.22 при повышении температуры величина свободной энергии обоих состояний уменьшается, но закон изменения свободной энергии изменяется в зависимости от жидкого состояния вещества и состояния твердого тела. Существуют теоретические и практические температуры кристаллизации. Ts-это теория RJ=Fn или равновесной температуры кристаллизации. При такой температуре Рав- ТПЛ ТКР Присутствие металлов как в жидком, так и в твердом состоянии маловероятно.
Фактическая кристаллизация начинается только в том случае, если этот процесс термодинамически благоприятен для системы DR=RZh-RTV, что требует переохлаждения. Людмила Фирмаль
Температура, при которой фактически происходит кристаллизация, называется Рис 1.22 влияние температуры на изменение энергии Гельмгольца F (свободная энергия) жидких и твердых металлов Ирис 1.23 кривая температуры кристаллизации металла с различными скоростями охлаждения Фактическая температура кристаллизации T. разность между теоретической и фактической температурами кристаллизации называется степенью переохлаждения: at=Ts-TKR. Чем больше степень переохлаждения, тем больше разница в свободной энергии AR, тем сильнее происходит кристаллизация. На диаграмме показаны тепловые кривые, характеризующие процесс охлаждения при различных скоростях. Степень переохлаждения мала и происходит при температуре, близкой к равновесию кристаллизации, с постепенным охлаждением, соответствующим кривой 1.23..
Горизонтальная область на тепловой кривой объясняется выделением скрытой теплоты кристаллизации, которая компенсирует тепловыделение. По мере увеличения скорости охлаждения (кривые v2, v3) степень переохлаждения возрастает, и процесс кристаллизации протекает при постоянно понижающейся температуре. Помимо скорости охлаждения, степень переохлаждения зависит от чистоты металла. Чем чище металл, тем выше степень переохлаждения. Поскольку переохлаждение до фактической температуры кристаллизации необходимо во время затвердевания, перегрев происходит во время плавления до тех пор, пока не будет достигнута фактическая температура плавления. Д. К.
Даже в Черновцах процесс кристаллизации состоит из 1)зарождения центров кристаллизации;2) роста кристаллов из этих центров. При температуре, близкой к температуре затвердевания, в жидком металле образуется небольшая группа атомов, называемых колебаниями, и атомы заполняются таким же образом, как и твердые кристаллы. Из некоторых таких колебаний образуются зародыши, или центры кристаллизации. По мере увеличения степени переохлаждения увеличивается число центров кристаллизации, образующихся за единицу времени. Кристаллы начинают расти вокруг образовавшихся центров кристаллизации. В то же время в жидкой фазе образуется новый центр кристаллизации. Увеличение общей массы затвердевшего металла происходит за счет появления новых центров кристаллизации и роста существующих.
Схема последовательных стадий процесса коагуляции показана на рисунке. 1.24, а-Г. 43A5 рисунок. 1.24 схема кристаллизации металла — *Х0 Четыре.- Х: 8г Взаимный рост кристаллов объясняет неправильную форму частиц. Настоящие твердые кристаллы неправильной формы называются кристаллитами. Скорость полной кристаллизации зависит от хода обоих элементарных процессов. Она определяется скоростью зарождения центров кристаллизации (NW) и скоростью роста (CP) кристаллов из этих центров(рис. 1.25). Величины СЗ и СР зависят от степени переохлаждения. При равновесной температуре=0 и Sz=O, CP=0. С увеличением Ат разница в свободной энергии AR=RZh-RTV увеличивается, растет с хорошей степенью подвижности атомов Sz и CP и достигает максимума. Последующее уменьшение Sz и CP объясняется уменьшением подвижности атома с уменьшением температуры.
При низких значениях коэффициента диффузии перегруппировка атомов жидкости в твердую кристаллическую решетку затруднена. При очень сильном переохлаждении NW и CP равны нулю, жидкость не кристаллизуется, а превращается в аморфное тело. В реальных металлах, как правило, реализуются только восходящие ветви кривых NW и SR, а с ростом at скорость обоих процессов возрастает. Ранее, если аморфное состояние достигалось только для солей, силикатов, органических веществ, то с помощью специальной технологии можно добиться высокой скорости охлаждения (более 106°С/С) и высокой температуры стекла металла.
Металл в стеклянном состоянии характеризуется особыми физико-механическими свойствами. Ядрами кристаллизации могут быть основные металлы, примеси, колебания в атомах различных твердых тел. Первый- Т. » Степень переохлаждения — это температура В одних случаях образуется однородный эмбрион, в других-гетерогенный. Возникновение однородного центра кристаллизации требует значительных энергозатрат. Для того чтобы эмбрион обладал достаточной термодинамической и физической силой, необходимо соответствовать- Рис 1.25 влияние степени переохлаждения на нуклеацию и скорость роста кристаллов Ирис 1.26, энергия Гельмгольца изменяется в зависимости от размера эмбриона В случае критического размера ГК.
Изменение свободной энергии при равномерном зарождении центров кристаллизации описывается формулой AF=-4/Zpg3&.ФГ++4lg2st, гдеФГ является изменение свободной энергии объема, и является свободной поверхностной энергии. Энергия, определяемая приведенной зависимостью, включает в себя затраты на появление зародыша и формирование интерфейса. Изменение энергии отрицательно, если процесс кристаллизации происходит при уменьшении свободной энергии, и положительно, если энергия системы увеличивается. Графически эта связь имеет вид, показанный на рисунке. Если зародыш 1,26 G0, если g=GK, так как AF положительна и ее значение увеличивается.
Размер зародыша g>ha, когда его роль в процессе кристаллизации становится определяющей, в это время DG
Плавление и кристаллизация металлов. Кристаллизация чистого металла. Условия образования мелкозернистой структуры
Плавление – это физический процесс перехода металла из твердого состояния в жидкое расплавленное. Плавление – процесс, обратный кристаллизации, происходит при температуре выше равновесной, т. е. при перегреве. Поскольку жидкий металл обладает большей внутренней энергией, чем твердый, при кристаллизации выделяется теплота. Между теплотой Q и температурой кристаллизации Тк существует определенная связь. Степень перегрева при плавлении металлов не превышает нескольких градусов. Переход металла из жидкого состояния в твердое (кристаллическое) называется кристаллизацией. Причиной кристаллизации является стремление системы перейти в термодинамически более устойчивое состояние с меньшей свободной энергией, т. е. когда свободная энергия кристалла меньше, свободной энергии жидкой фазы. Переход металла из одного состояния в другое происходит при определенной температуре и сопровождается резким изменением его свойств.Кристаллизация металлов, как впервые установил Д. К. Чернов в 1878 г., состоит из двух одновременно проходящих процессов: зарождения в жидком металле центров кристаллизации (ч.ц.) и роста кристаллов из этих центров (с.к.).Предположим, что на площади за секунду возникает пять зародышей будущих кристаллов, которые растут с определенной скоростью. К концу первой секунды образовалось пять зародышей, к концу второй они выросли и одновременно с этим возникли еще пять новых зародышей. Так, путем возникновения зародышей и их роста идет процесс кристаллизации до тех пор, пока не исчерпается вся жидкая фаза металла, т. е. кристаллизация закончится на седьмой секунде. В процессе кристаллизации, пока кристаллы окружены жидкостью, они имеют геометрически правильную форму и отличаются друг от друга размерами и ориентировкой. При соприкосновении и срастании кристаллов их правильная форма нарушается и их называют кристаллитами или зернами. Ответственные детали грузоподъёмных машин необходимо изготавливать из металлов с правильной кристаллизацией. Если вы решили приобрести лебедку скреперную, то лебедка 17лс от «Технологии подъёма» будет хорошим решением.Размер образовавшихся кристаллитов определяется соотношением скорости кристаллизации и числа центров. При большом значении с.к. и малом значении ч.ц., например образуется крупнокристаллическая структура. При малом значении с.к. и большом значении ч.ц. образуется мелкокристаллическая структура. Величина зерна зависит от температуры нагрева и разливки жидкого металла, его химического состава, наличия в нем посторонних примесей. Чем больше примесей, тем больше центров кристаллизации, тем мельче получается зерно.Использование специально вводимых в жидкий металл примесей для получения мелкого зерна получило название модифицирования. В качестве модификаторов алюминиевых сплавов применяют ванадий, натрий, калий, титан; в качестве модификаторов сталей — алюминий, ванадий, титан; в качестве модификаторов чугуна — магний и церий. Уменьшение величины зерен при кристаллизации сопровождается значительным повышением механических свойств металла (предела прочности, твердости и др.).
 Процесс кристаллизации чистого металла. До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии.
Процесс кристаллизации чистого металла. До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии.
Чем больше скорость образования зародышей и меньше скорость роста их, тем меньше размер кристалла (зерна), выросшего из одного зародыша, и, следовательно, более мелкозернистой будет структура металла. Стремятся к получению мелкозернистой структуры. Оптимальными условиями для этого являются: максимальное число центров кристаллизации и малая скорость роста кристаллов. Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды. Чем больше частичек, тем мельче зерна закристаллизовавшегося металла. Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации. Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы.
Материаловедение

Любое вещество может находиться в одном из четырех агрегатных состояний: твердом, жидком, газообразном и плазменном. Агрегатное состояние определяется энергией взаимодействия атомов. Стабильным (равновесным) при определенных внешних условиях является состояние вещества, при котором оно обладает минимумом свободной энергии. Свободная энергия — часть внутренней энергии вещества. Внутренняя энергия вещества — это сумма потенциальной энергии (энергии взаимодействия) и кинетической энергии частиц (тепловые колебания). Часть внутренней энергии, высвобождающаяся при переходе вещества из одного состояния в другое,называется свободной энергией. Чем больше высвободится свободной энергии, тем меньшей энергией будет обладать вещество, тем более стабильно его состояние. Свободную энергию можно представить как аналог потенциальной энергии (рис. 1).

Рисунок 1 — Стремление системы к уменьшению свободной энергии
В положении 1 шарик имеет максимальную потенциальную энергию. Это положение не является устойчивым, шарик скатывается в положение 2, при котором его потенциальная энергия будет равна 0. Вещество может находиться в метастабильном состоянии (закаленная сталь). Такое состояние не обладает минимумом свободной энергии, но является достаточно устойчивым (стабильным). Вещество в метастабильном состоянии может находиться бесконечно долго при условии постоянства внешних факторов.
Первичная кристаллизация металлов и сплавов. Кристаллизация — это переход металла из жидкого состояния в твердое с образованием кристаллического строения. Это первичная кристаллизация (в отличие от вторичной, когда кристаллы металлических фаз выделяются из твердого вещества).
Рассмотрение кристаллизации для металлов и сплавов на их основе связано с тем, что эти материалы получают методом литья, тогда как многие неметаллические материалы производят другими способами. Ряд неметаллических материалов существует в природном виде (углерод), многие химические соединения получают путем химических реакций: карбиды — карбидизацией, нитриды — азотированием и т.п. Процесс кристаллизации (затвердевания) обусловлен стремлением системы к переходу в более устойчивое термодинамическое состояние. При изменении внешних условий, например температуры, свободная энергия системы меняется различно для жидкого и твердого (кристаллического) состояния (рис. 2). Выше температуры Ts более стабильным
является жидкое состояние, так как металл в этом состоянии имеет меньший запас свободной энергии. Ниже температуры Ts меньшим запасом свободной энергии обладает металл в твердом состоянии. При температуре величины свободных энергий твердого и жидкого состояний равны. Это означает, что металл может находиться в обоих состояниях бесконечно долго, так как переход из одного состояния в другое не будет сопровождаться уменьшением свободной энергии. Температура Ts получила название теоретической температуры кристаллизации.

Рисунок 2 — Изменение свободной энергии (Ts) в зависимости от температуры (Т) жидкого (1) и твердого (2) состояния вещества
Для начала кристаллизации необходимо, чтобы свободная энергия металла в твердом состоянии стала меньше свободной энергии жидкого состояния. Это становится возможным при охлаждении жидкости ниже Ts. Температура, при которой фактически начинается процесс кристаллизации, называется фактической температурой кристаллизации (Тк). Охлаждение жидкого металла ниже теоретической температуры кристаллизации называется переохлаждение, а разность между теоретической и фактической температурой кристаллизации — степенью переохлаждения (ΔТ):
Степень переохлаждения зависит от скорости охлаждения жидкого металла. С увеличением скорости охлаждения понижается фактическая температура кристаллизации и, следовательно, возрастает степень переохлаждения. Процесс кристаллизации можно описать с помощью кривых охлаждения, построенных в координатах «температура — время» (рис. 3). Охлаждение в жидком состоянии сопровождается плавным понижением температуры (участок 1 кривой охлаждения), при достижении температуры кристаллизации на кривой охлаждения появляется горизонтальная площадка (участок 2 кривой охлаждения), т.е. охлаждение (понижение температуры) останавливается. Это вызвано тем, что отвод тепла компенсируется выделяющейся в процессе кристаллизации скрытой
теплотой кристаллизации. После полного перехода металла из жидкого состояния в твердое температура вновь начинает плавно снижаться (участок 3 кривой охлаждения). Увеличение скорости охлаждения от V1 до V3 приводит к увеличению степени
переохлаждения (см. рис. 3).

Рисунок 3 — Кривые охлаждения металла
Кристаллизация начинается с образования в жидком металле центров кристаллизации и продолжается за счет роста их числа и размеров (рис. 4). Процесс кристаллизации можно охарактеризовать двумя параметрами: числом центров кристаллизации (ЧЦК),

Рисунок 4- Схема процесса кристаллизации
образующихся в единицу времени в единице объема (1 см 3 /с), и скоростью роста кристаллов (СК ) [мм /с]. Эти параметры зависят от степени переохлаждения, а следовательно, от скорости охлаждения при кристаллизации металла. В соответствии с законом Таммана для каждой степени переохлаждения указанные параметры могут иметь только одно значение (рис. 5).
При теоретической температуре кристаллизации ( Ts) значения ЧЦК и СК равны 0 и кристаллизация происходить не может. При повышении степени переохлаждения значения ЧЦК и СК возрастают, процесс кристаллизации идет быстро. Это объясняется тем, что при высоких температурах, близких к Тs подвижность атомов велика. При определенных степенях переохлаждения значения ЧЦК и СК достигают максимума, после чего снижаются вследствие уменьшения подвижности атомов при низких температурах.
Размер образовавшихся в процессе кристаллизации зерен зависит от соотношения величин ЧЦК и СК, т.е. определяется степенью переохлаждения (скоростью охлаждения
металла в процессе кристаллизации). При малых степенях переохлаждения (низкой скорости охлаждения металла) образуется малое число центров кристаллизации, которые
растут с большой скоростью,—- АТ’ (см. рис. 5). В этом случае структура металла после окончания кристаллизации будет крупнозернистой. При больших степенях переохлаждения, напротив, ЧЦК велико, а СК мала (ДГ» — АТ”’), поэтому структура металла получается мелкозернистой.
Если степень переохлаждения настолько велика, что значения ЧЦК и СК близки к пулю, кристаллизации не происходит. При этом образуется твердое тело, имеющее не кристаллическое строение с «правильным» расположением атомов, а аморфное — с хаотическим расположением атомов — «твердая жидкость». Аморфное состояние
характерно для неметаллических материалов (стекла, полимеры). Для получения аморфного состояния у металлических материалов требуется очень большая скорость охлаждения 10 6 . 10 7 °С/с.